题目内容
砷(As)为第4周期ⅤA族元素,根据元素周期表和元素周期律的知识,下列有关推测不正确的是( )
分析:砷(As)为第4周期ⅤA族元素,最外层电子数为5,最低价为-3价,最高价为+5价,结合非金属性越强最高价含氧酸酸性越强,气态氢化物越稳定来解答.
解答:解:A.ⅤA族元素,则砷可以有-3、+3、+5等多种化合价,故A正确;
B.砷的电子排布中各层的电子数为2、8、18、5,则砷原子的第3电子层含有18个电子,故B正确;
C.同主族从上到下非金属性减弱,非金属性P>As,则H3AsO4的酸性比H3PO4弱,故C正确;
D.非金属性P>As,则砷的氢化物的稳定性比磷化氢的弱,故D错误;
故选D.
B.砷的电子排布中各层的电子数为2、8、18、5,则砷原子的第3电子层含有18个电子,故B正确;
C.同主族从上到下非金属性减弱,非金属性P>As,则H3AsO4的酸性比H3PO4弱,故C正确;
D.非金属性P>As,则砷的氢化物的稳定性比磷化氢的弱,故D错误;
故选D.
点评:本题考查元素周期律和元素周期表,明确同主族元素的性质变化规律及非金属性比较的方法即可解答,题目难度不大.

练习册系列答案
相关题目
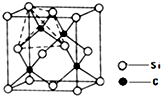 (2013?青岛一模)[化学-物质结构与性质]
(2013?青岛一模)[化学-物质结构与性质]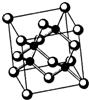 (2013?无锡一模)[物质结构与性质]
(2013?无锡一模)[物质结构与性质]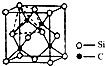 (2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
(2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.