题目内容
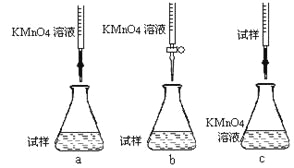
【题目】已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1 L,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是________,一定存在的阳离子是________。
(2)写出NH4+的电子式________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为____,所得沉淀的最大质量是___g。
(4)若通过实验确定原废水中c(Na+) =0.18 mol·L-1,试判断原废水中NO3-是否存在?________(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)=________ mol·L-1。(若不存在或不确定则此空不填)
【答案】CO32- Na+、H+、Al3+、Mg2+、NH4+  2:1 10.7 存在 0.08
2:1 10.7 存在 0.08
【解析】
无色废水确定无Fe3+,根据实验①确定有Na+,根据实验②确定有SO42-,根据实验③确定有Al3+,一定不含CO32-,故溶液中存在的离子为:Na+、H+、Al3+、Mg2+、NH4+,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(H+),再根据电荷守恒确定有没有NO3-。
(1)根据实验①确定存在Na+,根据实验②确定存在SO42-,根据实验③图像确定有H+、Al3+、NH4+、Mg2+,没有Fe3+,因为CO32-与Al3+不能共存,所以无CO32-;故答案为:CO32-; Na+、H+、Al3+、Mg2+、NH4+;
(2)铵根是复杂阳离子,其电子式为: ,故答案为:
,故答案为: ;
;
(3)图象中横坐标0.7~0.8段发生反应Al(OH)3+OH-=AlO2-+2H2O,则生成氢氧化铝沉淀的物质的量为0.1mol;0.1~0.5段Al3+、Mg2+与NaOH反应生成Al(OH)3、Mg(OH)2沉淀,总共消耗0.4molNaOH,结合Al3++3OH-=Al(OH)3↓可知生成0.1molAl(OH)3消耗0.3molNaOH,n(Al3+)=0.1mol,根据Mg2++2OH-=Mg(OH)2↓可知生成Mg(OH)2沉淀消耗NaOH的物质的量为:0.4mol-0.3mol=0.1mol,所以n[Mg(OH)2]=![]() n(NaOH)=0.05mol,所得沉淀的最大质量是:78g/mol×0.1mol+58g/mol×0.05mol=10.7g,0.5~0.7段发生反应NH4++OH-=NH3H2O,n(NH4+)=0.2mol,在原溶液中c(NH4+)与c(Al3+)的比值为2:1,故答案为:2:1;10.7;
n(NaOH)=0.05mol,所得沉淀的最大质量是:78g/mol×0.1mol+58g/mol×0.05mol=10.7g,0.5~0.7段发生反应NH4++OH-=NH3H2O,n(NH4+)=0.2mol,在原溶液中c(NH4+)与c(Al3+)的比值为2:1,故答案为:2:1;10.7;
(4)0~0.1段发生反应H++OH-=H2O,则n(H+)=0.1mol,0.5~0.7段发生反应NH4++OH-=NH3H2O,n(NH4+)=0.2mol,生成的93.2g白色沉淀为硫酸钡,n(SO42-)=![]() =0.4mol,根据(2)可知,溶液中还会有n(Al3+)=0.1mol、n(Mg2+)=0.05mol,n(Na+)=0.18mol/L×1L=0.18mol,根据电荷守恒可知:c(NO3-)×1L=3n(Al3+)+2n(Mg2+)+n(Na+)+n(NH4+)+n(H+)-2n(SO42-)=0.1mol×3+0.05mol×2+0.18mol+0.1mol+0.2mol-0.4mol×2=0.08mol,则c(NO3-)=0.08molL-1,故答案为:存在;0.08。
=0.4mol,根据(2)可知,溶液中还会有n(Al3+)=0.1mol、n(Mg2+)=0.05mol,n(Na+)=0.18mol/L×1L=0.18mol,根据电荷守恒可知:c(NO3-)×1L=3n(Al3+)+2n(Mg2+)+n(Na+)+n(NH4+)+n(H+)-2n(SO42-)=0.1mol×3+0.05mol×2+0.18mol+0.1mol+0.2mol-0.4mol×2=0.08mol,则c(NO3-)=0.08molL-1,故答案为:存在;0.08。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案