题目内容
10.酸雨雨水PH<5.6(选‘>’,‘<’,‘=’填入),这是因为雨水中溶解了SO2或NO2(填一种造成酸雨最主要的物质)造成的.分析 正常的雨水常呈微酸性,这是由于在雨水中溶解了二氧化碳.通常所说的酸雨是指pH<5.6的雨水,当空气受二氧化硫或二氧化氮的污染时雨水便呈酸性.
解答 解:正常雨水显酸性的原因是二氧化碳与水反应生成显酸性的碳酸(pH<7),反应的化学方程式为:CO2+H2O═H2CO3,当空气受二氧化硫或二氧化氮的污染时,它们分别和水反应生成亚硫酸、硝酸使雨水呈酸性,
故答案为:<;SO2或NO2.
点评 本题考查酸雨的有关知识,掌握二氧化碳的化学性质、酸雨形成的原因是正确解答本题的关键,题目难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 用氯化钡溶液可区别SO42-和CO32-离子 | |
| B. | 只能用加入试剂的方法区别(NH4)2 SO4和Fe2(SO4)3溶液 | |
| C. | 用丁达尔效应可区别Fe(OH)3胶体和饱和FeCl3溶液 | |
| D. | 用澄清石灰水可区别Na2CO3溶液和NaHCO3溶液 |
1.如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知,过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将发生的现象是( )

| A. | U形管内红色褪去 | B. | 试管内溶液变红 | C. | 气球a被吹大 | D. | U形管水位d<c |
5.在一定温度下,下列叙述中属于可逆反应A(g)+B(g)?2C(g)达到平衡标志的是( )
| A. | C的生成速率与C的分解速率相等 | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内消耗a mol A的同时消耗a mol B | |
| D. | A、B、C的物质的量之比为1:1:2 |
15.判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.几种实例如下表所示.
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大.亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:亚磷酸 ,亚砷酸
,亚砷酸 .
.
(2)分别写出亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式.亚磷酸:H3PO3+2NaOH=Na2HPO3+2H2O,亚砷酸:H3AsO3+3NaOH=Na3AsO3+3H2O.
(3)比较H3AsO4、H2CrO4、HMnO4的酸性强弱,酸性由弱到强的顺序H3AsO4、H2CrO4、HMnO4.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  | 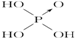 |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 ,亚砷酸
,亚砷酸 .
.(2)分别写出亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式.亚磷酸:H3PO3+2NaOH=Na2HPO3+2H2O,亚砷酸:H3AsO3+3NaOH=Na3AsO3+3H2O.
(3)比较H3AsO4、H2CrO4、HMnO4的酸性强弱,酸性由弱到强的顺序H3AsO4、H2CrO4、HMnO4.
2.如图是锂-空气电池放电和充电时的工作示意图.下列说法正确的是( )


| A. | 该电池放电时,图中电极a是正极,c是负极 | |
| B. | 该电池放电时,水性电解质pH不变 | |
| C. | 当给该锂-空气电池充电时,c极应接电源的负极 | |
| D. | 当给该锂-空气电池充电时,b极的电极反应式为4OH--4e-=2H2O+O2↑ |
19.常温下,pH=2的强酸溶液与pH=13的强碱溶液混合后,所得溶液的pH=11,则强酸和强碱的体积比为( )
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:1 |
20.下列是元素A的两种同位素的资料
元素A的近似相对原子质量为104.6(列出计算式)
| 同位素 | 同位素的质量分数 | 原子百分比 |
| 103A | 103 | 20% |
| 105A | 105 | 80% |
