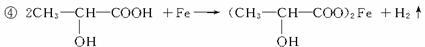题目内容
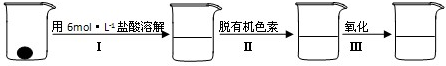
补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01mol?L-1、0.008mol?L-1等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
②样品处理

③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10mL
④比色,直到与选取的标准颜色一致或相近即可.
试回答下列问题:
(1)配制25mL0.01mol?L-1标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:______,若配制过程中定容时俯视刻度会使配制的浓度______(填偏大、偏小、不影响).
(2)步骤②脱色过程包括加入:______(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→______(填操作).
(3)比色法确定待测液的浓度的原理是______
(4)已知有关离子的还原性顺序为I->Fe2+>SCN->Br->Cl-,则步骤②中Ⅲ可选择的氧化剂有______a.碘水 b.溴水 c.氯水 d.通入(SCN)2;写出加入上述某一氧化剂时涉及到的离子反应方程式:______
(5)若其补铁剂是由乳酸

与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:______.
①配制0.01mol?L-1、0.008mol?L-1等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
②样品处理

③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10mL
④比色,直到与选取的标准颜色一致或相近即可.
试回答下列问题:
(1)配制25mL0.01mol?L-1标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:______,若配制过程中定容时俯视刻度会使配制的浓度______(填偏大、偏小、不影响).
(2)步骤②脱色过程包括加入:______(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→______(填操作).
(3)比色法确定待测液的浓度的原理是______
(4)已知有关离子的还原性顺序为I->Fe2+>SCN->Br->Cl-,则步骤②中Ⅲ可选择的氧化剂有______a.碘水 b.溴水 c.氯水 d.通入(SCN)2;写出加入上述某一氧化剂时涉及到的离子反应方程式:______
(5)若其补铁剂是由乳酸

与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:______.
(1)反应操作步骤有量取、溶解、移液、洗涤、定容、摇匀等操作,首先用量筒量量取一定体积的溶液在烧杯中溶解,冷却后转移到25ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加;定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏大,
故答案为:25mL容量瓶、胶头滴管;偏大;
(2)活性炭具有吸附性,可用来脱色,具有漂白性,脱色后,活性炭不溶于水,可用过滤的方法分离,故答案为:活性炭;过滤;
(3)溶液浓度越大,颜色越深,故答案为:溶液颜色与物质的量浓度成正比;
(4)由于离子的还原性顺序为I->Fe2+>SCN->Br->Cl-,所以溴水、氯水能将亚铁离子氧化为铁离子.加入氯水反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-,
故答案为:bc;Cl2+2Fe2+=2Fe3++2Cl-;
(5)该补铁剂为乳酸亚铁[CH3CH(OH)COO]2Fe,乳酸具有弱酸性,利用强酸制弱酸.所以盐酸与乳酸亚铁[CH3CH(OH)COO]2Fe生成乳酸和氯化亚铁,反应方程式为[CH3CH(OH)COO]2Fe+2HCl→2CH3CH(OH)COOH+FeCl2,故答案为:[CH3CH(OH)COO]2Fe+2HCl→2CH3CH(OH)COOH+FeCl2.
故答案为:25mL容量瓶、胶头滴管;偏大;
(2)活性炭具有吸附性,可用来脱色,具有漂白性,脱色后,活性炭不溶于水,可用过滤的方法分离,故答案为:活性炭;过滤;
(3)溶液浓度越大,颜色越深,故答案为:溶液颜色与物质的量浓度成正比;
(4)由于离子的还原性顺序为I->Fe2+>SCN->Br->Cl-,所以溴水、氯水能将亚铁离子氧化为铁离子.加入氯水反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-,
故答案为:bc;Cl2+2Fe2+=2Fe3++2Cl-;
(5)该补铁剂为乳酸亚铁[CH3CH(OH)COO]2Fe,乳酸具有弱酸性,利用强酸制弱酸.所以盐酸与乳酸亚铁[CH3CH(OH)COO]2Fe生成乳酸和氯化亚铁,反应方程式为[CH3CH(OH)COO]2Fe+2HCl→2CH3CH(OH)COOH+FeCl2,故答案为:[CH3CH(OH)COO]2Fe+2HCl→2CH3CH(OH)COOH+FeCl2.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在探究某补铁剂中铁元素的价态实验中,老师取一片该补铁剂用盐酸溶解,经脱色过滤后,得到250 mL近乎无色的溶液,继续加入1滴液溴,振荡,溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,因Br2水本就呈棕黄色,使溶液变黄色的物质是Br2;乙同学认为这是发生化学反应所致,使溶液变黄色的物质是_________(填粒子的化学式),发生反应的离子方程式为__________________________________________。
(2)现提供以下试剂:A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氧化碳 D.硫氰化钾溶液。请你用两种方法支持乙同学,写出选用的试剂编号及实验中应观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
(3)用(2)中所提供的试剂即可验证该补铁剂经脱色后的溶液中含Fe2+而不含Fe3+。请写出实验步骤和现象。
| 实验步骤 | 实验现象 |
(4)补铁剂中铁元素含量的测定通常使用到双氧水,请写出将双氧水滴入该补铁剂经脱色后的溶液中发生反应的离子方程式______________________________________________。
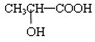 与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:
与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式: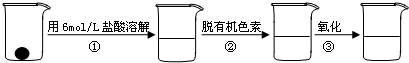
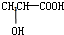 )与铁粉作用生成的,请写出该反应的化学方程式:
)与铁粉作用生成的,请写出该反应的化学方程式: