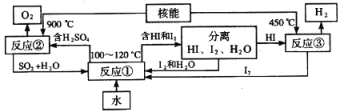
题目内容
【题目】在图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
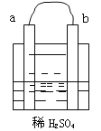
A. 碳棒上有气体放出,溶液的pH增大
B. 导线中有电子流动,电子从a极流到b极
C. a是正极,b是负极
D. a极上发生了氧化反应
【答案】C
【解析】
a的活动性比氢要强,b为碳棒,该装置能发生自发的氧化还原反应,构成原电池,a作负极,碳棒作正极,负极上金属失电子发生氧化反应,碳棒上氢离子得电子发生还原反应,据此分析解答。
A.该原电池中金属作负极,碳棒b作正极,负极上金属失电子发生氧化反应,正极碳上氢离子得电子发生还原反应,碳棒上有气体放出,溶液中氢离子浓度减小,溶液的pH增大,故A正确;
B.该装置是原电池,有电流产生,电子从负极a沿导线流向正极b,故B正确;
C.该原电池中,金属的金属性大于氢元素,所以金属a作负极,碳棒b作正极,故C错误;
D.a作负极,负极上金属失电子发生氧化反应,故D正确;
答案选C。

练习册系列答案
相关题目
【题目】下列离子组在给定条件下能否大量共存的判断正确,所发生反应的离子方程式也正确的是
选项 | 条件 | 离子组 | 离子共存判断及反应离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能共存,Al3++3OH-=Al(OH)3↓ |
B | pH =1的溶液 | Fe2+、Al3+、SO42-、MnO4- | 不能共存,5Fe2++MnO4-+8H+= Mn2++5Fe3++4H2O |
C | 由水电离出的H+浓度为1×10-12 mol·L-1 | NH4+、Na+、NO3-、Cl- | 一定能共存,NH4++ H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能共存,2C1O- +SO2+H2O=2HC1O+SO32- |
A. A B. B C. C D. D