题目内容
【题目】下图为铁制品循环利用的示意图,根据图示回答:
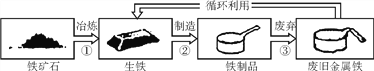
(1)从“①”“②”“③”中,选出一定发生化学变化的是____(填序号)。
(2)不能用铁制容器盛放硫酸铜溶液的原因是_____________ (用化学方程式表示)。
(3)废旧金属“循环利用”的意义是____________。
【答案】 ① Fe+CuSO4===FeSO4+Cu 节约金属资源,树立可持续发展的观念(或保护金属资源或节约能源或减少对环境的污染等)
【解析】(1)铁矿石生成生铁是利用铁矿石氧化铁被还原,生成铁,是化学变化,生铁制成铁制品没有新物质的生成,是物理变化,铁制品变为废旧铁可能发生化学变化也可能不发生化学变化,故选①;
(2)金属铁比金属铜活泼,故铁可以把硫酸铜中的铜置换出来,反应方程式为:Fe+CuSO4===FeSO4+Cu
(3)废旧金属“循环利用”可以节约金属资源,树立可持续发展的观念(或保护金属资源或节约能源或减少对环境的污染等)。

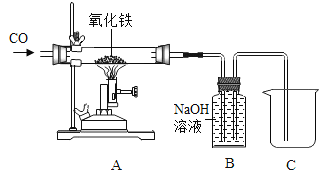
【题目】碳及其化合物有广泛的用途.
(1)反应C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJmol﹣1 , 达到平衡后,体积不变时,以下有利于提高H2产率的措施是 .
A.增加碳的用量
B.升高温度
C.用CO吸收剂除去CO
D.加入催化剂
(2)已知,C(s)+CO2(g)2CO(g)△H=+172.5kJmol﹣1则反应 CO(g)+H2O(g)CO2(g)+H2(g)△H= .
(3)CO与H2一定条件下反应生成甲醇(CH3OH),可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池负极反应式为 .
(4)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下数据:
t/min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它条件不变,降低温度,达到新平衡前 v(逆)v(正)(填“>”、“<”或“=”).
②该温度下,此反应的平衡常数K=;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数
(填“增大”、“减小”或“不变”).
【题目】高纯度的氢氧化镁广泛应用于医药、电力等领域.镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图1: 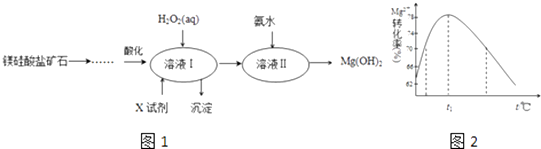
已知1:溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)向溶液Ⅰ中加入X的作用是 .
(2)向溶液Ⅰ中加入的两种试剂先后顺序是(填化学式).
(3)加入H2O2溶液反应的离子方程式是 .
(4)如图2是Mg2+转化率随温度t的变化示意图:
①t1前Mg2+转化率增大的原因是;t1后Mg2+转化率下降的原因是(用化学方程式表示) .
②向溶液Ⅱ中加入氨水反应的离子方程式是 .