题目内容
 在如图①、②、③、④四条曲线中,能正确表示将一定浓度的NaOH溶液加水稀释,其pH与加水的体积(V)的关系的是( )
在如图①、②、③、④四条曲线中,能正确表示将一定浓度的NaOH溶液加水稀释,其pH与加水的体积(V)的关系的是( )| A、① | B、② | C、③ | D、④ |
分析:稀释之前氢氧化钠溶液的pH大于7,随着加入的蒸馏水体积的不断增大,溶液中氢氧根离子浓度逐渐减小,溶液的pH逐渐减小,当氢氧根离子浓度减小到接近10-7mol/L时,溶液的pH接近7,但是不会等于7,据此进行解答.
解答:解:氢氧化钠溶液为碱性溶液,溶液的pH>7;根据Kw=c(H+)×c(OH-)可得:c(H+)=
,随着水的体积增大,溶液中的c(OH-)逐渐降低,c(H+) 逐渐增大,溶液的pH值逐渐减小;当无限稀释时,氢氧化钠浓度无限小,可近似认为是水,水中的 c(H+) 的浓度近似为10-7mol/L,所以pH值接近为7,
故选B.
| KW |
| c(OH-) |
故选B.
点评:本题考查了溶液的稀释与溶液PH值的关系,题目难度不断,注意明确酸无论如何稀释不能变成碱液,碱无论如何稀释不能变成酸溶液,当无限稀释时要考虑水的电离,所以导致酸溶液无论如何稀释不能变成碱溶液,碱无论如何稀释不能变成酸溶液.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目

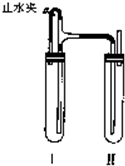 (2011?佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.
(2011?佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.
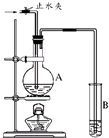 在如图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液.
在如图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液.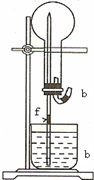 在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是