题目内容
下列有关物质性质及对应用途的说法正确的是( )
A.利用浓硫酸的脱水性,干燥氢气
B.氧化镁熔点高,可用于制造耐火 材料
材料
C.碳酸钠溶液呈碱性,可用于治疗胃酸过多
D.二氧化硫有漂白性,故可使酸性高锰酸钾溶液褪色
下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入到含1 2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-=HClO+HSO | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合: 2AlO |
|
钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
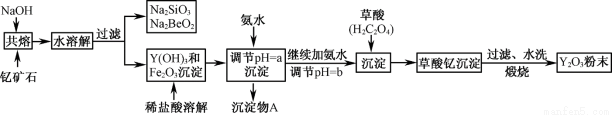
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | |
Fe3+ | 2.7 | 3.7 | |
Y3+ | 6.0 | 8.2 | |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和 两种试剂,再通过必要的操作即可实现。
A.NaOH溶液  B.氨水 C.CO2 D.HNO3
B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(2)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在 范围内;继续加氨水调节pH =b发生反应的离子方程式为 ;检验Fe3+是否沉淀完全的操作方法是 。
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3.nH2O]煅烧的化学方程式 。
(1)有一学生在实验室测某溶液pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
①这种错误操作 (填“一定”/“一定不”/“不一定”)会导致实验结果有误差。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 。
(2)、用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考右图,从表中选出正确序号
序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |
|
A | 碱 | 酸 | 石 | (乙) |
B | 酸 | 碱 | 酚酞 | (甲) |
C | 碱 | 酸 | 甲基橙 | (甲) |
D | 酸 | 碱 | 酚酞 | (乙) |
(3)、用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应中正、逆反应速率的关系式是
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断


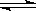 CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表: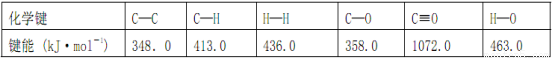
 应式为_______________。
应式为_______________。 N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图: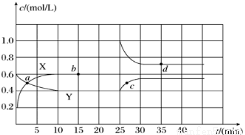

 变化而改变
变化而改变 。
。 mol FeI2溶液中:
mol FeI2溶液中: +OH-=MgCO3↓+H2O
+OH-=MgCO3↓+H2O +5H+=Al3++Al(OH)3↓+H2O
+5H+=Al3++Al(OH)3↓+H2O 正确;AlO
正确;AlO
 、A2B
、A2B
 选用滴定管
选用滴定管 芯
芯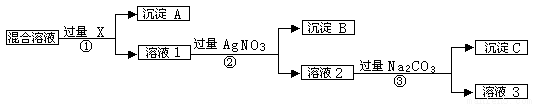 请回答下列问题:
请回答下列问题: