题目内容
0.80gCuSO4?5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
请回答下列问题:
(1)试确定200℃时固体物质的化学式______(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______ CuO+SO3↑
【答案】分析:(1)由图分析可知,CuSO4?5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,根据相应的化学方程式即可确定此时固体物质的化学式;
(2)温度为570℃灼烧得到的黑色粉末是CuO,氧化性气体则为SO3,反应方程式为:CuSO4 CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为
CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为
CuSO4?5H2O;根据图象分析其存在的最高102℃;
(3)根据浓硫酸具有强氧化性进行分析并写出有关的化学方程式;
(4)根据溶度积常数进行计算c(Cu2+),根据溶液的电中性计算H+浓度.
解答:解:(1)CuSO4?5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,
根据反应的化学方程式:
CuSO4?5H2O CuSO4?(5-n)H2O+nH2O
CuSO4?(5-n)H2O+nH2O
250 18n
0.80g 0.80g-0.57g=0.23g
 ,解得n=4,
,解得n=4,
200℃时该固体物质的化学式为CuSO4?H2O,故答案为CuSO4?H2O;
(2)温度为570℃灼烧得到的黑色粉末应是CuO,氧化性气体则为SO3,反应方程式为:CuSO4 CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,
CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,
蒸发浓缩、冷却得到的晶体为CuSO4?5H2O;其存在的最高102℃.故答案为:CuSO4 CuO+SO3↑; CuSO4?5H2O;102℃;
CuO+SO3↑; CuSO4?5H2O;102℃;
(3)SO3与水反应生成硫酸,浓硫酸与铜加热反应的化学方程式为:2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O,故答案为:2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O,故答案为:2H2SO4(浓)+Cu  CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)根据题给Cu(OH)2的溶度积即可确定pH=8时,c(OH-)=10-6mol/L,Ksp[Cu(OH)2]=2.2×10-20,则c(Cu2+)=2.2×10-8mol?L-1;在0.1mol?L-1硫酸铜溶液中通入
过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42-)不变,为0.1mol?L-1,由电荷守恒可知c(H+)为0.2mol?L-1.故答案为:2.2×10-8;0.2.
点评:本题考查硫酸铜结晶水含量的测定、溶度积常数的计算以及物质的量浓度的有关计算,题目较为综合,分析图象信息是完成本题目的关键.
(2)温度为570℃灼烧得到的黑色粉末是CuO,氧化性气体则为SO3,反应方程式为:CuSO4
 CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为
CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为CuSO4?5H2O;根据图象分析其存在的最高102℃;
(3)根据浓硫酸具有强氧化性进行分析并写出有关的化学方程式;
(4)根据溶度积常数进行计算c(Cu2+),根据溶液的电中性计算H+浓度.
解答:解:(1)CuSO4?5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,
根据反应的化学方程式:
CuSO4?5H2O
 CuSO4?(5-n)H2O+nH2O
CuSO4?(5-n)H2O+nH2O250 18n
0.80g 0.80g-0.57g=0.23g
 ,解得n=4,
,解得n=4,200℃时该固体物质的化学式为CuSO4?H2O,故答案为CuSO4?H2O;
(2)温度为570℃灼烧得到的黑色粉末应是CuO,氧化性气体则为SO3,反应方程式为:CuSO4
 CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,
CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为CuSO4?5H2O;其存在的最高102℃.故答案为:CuSO4
 CuO+SO3↑; CuSO4?5H2O;102℃;
CuO+SO3↑; CuSO4?5H2O;102℃;(3)SO3与水反应生成硫酸,浓硫酸与铜加热反应的化学方程式为:2H2SO4(浓)+Cu
 CuSO4+SO2↑+2H2O,故答案为:2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O,故答案为:2H2SO4(浓)+Cu  CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;(4)根据题给Cu(OH)2的溶度积即可确定pH=8时,c(OH-)=10-6mol/L,Ksp[Cu(OH)2]=2.2×10-20,则c(Cu2+)=2.2×10-8mol?L-1;在0.1mol?L-1硫酸铜溶液中通入
过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42-)不变,为0.1mol?L-1,由电荷守恒可知c(H+)为0.2mol?L-1.故答案为:2.2×10-8;0.2.
点评:本题考查硫酸铜结晶水含量的测定、溶度积常数的计算以及物质的量浓度的有关计算,题目较为综合,分析图象信息是完成本题目的关键.

练习册系列答案
相关题目



 +5H2
+5H2

 +n
+n

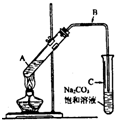 (2009?成都一模)某兴趣小组利用如图装置,取不同浓度的硫酸与 3mL 无水乙醇和 2mL 冰醋酸分别进行制取乙酸乙酯的研究.
(2009?成都一模)某兴趣小组利用如图装置,取不同浓度的硫酸与 3mL 无水乙醇和 2mL 冰醋酸分别进行制取乙酸乙酯的研究. CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O