题目内容
【题目】氯化亚铜![]() ,白色、易被氧化,
,白色、易被氧化,![]() 广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉
广泛用作催化剂、媒染剂、脱色剂等。工业上用初级铜矿粉![]() 主要含
主要含![]() 、CuS、
、CuS、![]() 、FeO等
、FeO等![]() 制备活性CuCl的流程如下:
制备活性CuCl的流程如下:
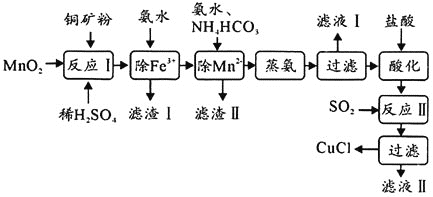
(1)滤渣Ⅰ是![]() 和单质硫的混合物,反应Ⅰ中
和单质硫的混合物,反应Ⅰ中![]() 参与反应的化学方程式为:
参与反应的化学方程式为:![]() 未配平
未配平![]() ,氧化产物为________。
,氧化产物为________。
(2)除![]() 时得
时得![]() 沉淀,该反应的离子方程式为________。
沉淀,该反应的离子方程式为________。
(3)已知![]() 可溶于氨水形成深蓝色溶液:
可溶于氨水形成深蓝色溶液:![]() 。蒸氨条件及蒸氨效果见下表:
。蒸氨条件及蒸氨效果见下表:
序号 | 温度 | 时间 | 压强 | 残液颜色 |
a | 110 | 60 |
| 浅蓝色 |
b | 100 | 40 |
| 几乎很浅 |
c | 90 | 30 |
| 无色透明 |
由表中信息可知蒸氨的条件应选________![]() 填序号
填序号![]() 。
。
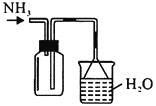
蒸出的氨气可以回收利用,在实验室用如图装置来收集。当集气瓶收集满氨气时观察到的现象是________。
(4)反应Ⅱ的离子方程式为________。
【答案】![]() 、S
、S ![]()
![]()
![]()
![]()
![]() 漏斗中的液面忽上忽下
漏斗中的液面忽上忽下 ![]()
![]()
![]()
![]()
【解析】
(1)该反应中![]() 发生氧化反应生成
发生氧化反应生成![]() 和S;
和S;
(2)除![]() 时加入氨水和
时加入氨水和![]() ,得
,得![]() 沉淀;
沉淀;
(3)根据表中信息,c得到的残液颜色为无色透明,说明![]() 转换率最大;
转换率最大;
实验室用题图装置收集满氨气时,氨气溶解使烧杯中液面上升,溶液进入漏斗,在重力作用下,溶液又会下落,如此反复;
(4)蒸氨后过滤得到![]() ,加入盐酸酸化得到
,加入盐酸酸化得到![]() 溶液,向
溶液,向![]() 溶液中通入
溶液中通入![]() 制得CuCl,
制得CuCl,![]() 被还原成CuCl,则
被还原成CuCl,则![]() 被氧化成
被氧化成![]() 。
。
(1)该反应中![]() 发生氧化反应生成
发生氧化反应生成![]() 和S,故氧化产物为
和S,故氧化产物为![]() 、S;故答案为:
、S;故答案为:![]() 、S;
、S;
(2)除![]() 时加入氨水和
时加入氨水和![]() ,得
,得![]() 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为![]() ;故答案为:
;故答案为:![]() ;
;
(3)蒸氨的目的是使平衡![]() 向逆反应方向移动,根据表中信息,c得到的残液颜色为无色透明,说明
向逆反应方向移动,根据表中信息,c得到的残液颜色为无色透明,说明![]() 转换率最大,故蒸氨的条件应选c。实验室用题图装置收集满氨气时,氨气溶解使烧杯中液面上升,溶液进入漏斗,在重力作用下,溶液又会下落,如此反复;故答案为:c;漏斗中的液面忽上忽下;
转换率最大,故蒸氨的条件应选c。实验室用题图装置收集满氨气时,氨气溶解使烧杯中液面上升,溶液进入漏斗,在重力作用下,溶液又会下落,如此反复;故答案为:c;漏斗中的液面忽上忽下;
(4)蒸氨后过滤得到![]() ,加入盐酸酸化得到
,加入盐酸酸化得到![]() 溶液,向
溶液,向![]() 溶液中通入
溶液中通入![]() 制得CuCl,
制得CuCl,![]() 被还原成CuCl,则
被还原成CuCl,则![]() 被氧化成
被氧化成![]() ,根据得失电子守恒、原子守恒配平化学方程式为
,根据得失电子守恒、原子守恒配平化学方程式为![]() ,故反应Ⅱ的离子方程式为
,故反应Ⅱ的离子方程式为![]() ;故答案为:
;故答案为:![]() 。
。

 学习实践园地系列答案
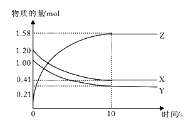
学习实践园地系列答案【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
容器 | 甲 | 乙 | 丙 |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 3.0molA 1.0molB |
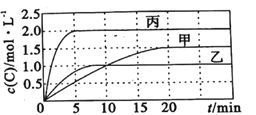
则: (1)该反应为____________(填 “放热反应”或“吸热反应”)
(2)丙容器中前5分钟的A的反应速率为__________
(3)该可逆反应达到平衡后,为在提高反应速率的同时提高B的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入A和B b.改用高效催化剂 c.升高温度 d.增加A的浓度 e. 增加C的浓度
(4)乙容器中的化学平衡常数为_____________