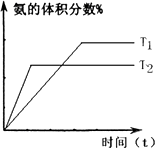
题目内容
一定温度下,在5 L的密闭容器中,加入3 mol CO和9 mol H2O,发生如下反应CO(g)+H2O(g)![]() CO2(g)+H2(g),到达平衡时测得H2O(g)的体积分数为
CO2(g)+H2(g),到达平衡时测得H2O(g)的体积分数为![]() .
.
(1)计算该反应的平衡常数.
(2)若起始时加入CO和H2O各2 mol,保持温度不变,到达平衡时CO的转化率
是多少?(本题两个小题都要求写出计算过程.)
解析:
(1)0.0625(计算过程2分,结果2分.)
(2)20%(计算过程2分,结果2分.)

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 |
|
|
(1)反应②是?????? (填“吸热”或“放热”)反应。
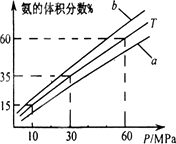
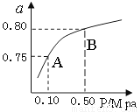
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A)???????????? K(B)(填“>”、“<”或“=”)。
(3)判断反应③△H?????? 0; △S?????? 0(填“>”“=”或“<”)据反应①与②可推导出K1、K2与K3之间的关系,则K3=?????????? (用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) ????? v(逆) (填“>”“=”或“<”)
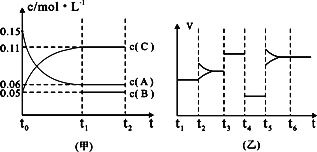
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
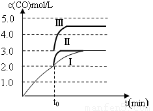
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是??????????????????? 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是?????????????????? 。
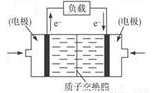
(5)甲醇燃料电池通常采用铂电极,其工作原理如图所示,负极的电极反应为:?????????????????????? 。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的醋酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为 ???????????????????????????????? 。