题目内容
7.(1)Al位于元素周期表第第三周期第IIIA族,其基态原子最外层有3个电子.(2)N和O的气态氢化物中,较稳定的是H2O(写氢化物化学式).
(3)写出Na2O2与CO2反应的化学方程式,并标出电子转移的方向和数目:
 .
.(4)氢元素、碳元素、氧元素的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:HCO3-+CH3COOH→CH3COO-+CO2↑+H2O.
分析 (1)电子层数等于周期序数,主族序数等于元素最外层电子数;
(2)元素非金属性越强对应氢化物越稳定;
(3)反应生成碳酸钠和氧气,反应中O元素的化合价既升高又降低;
(4)氢元素、碳元素、氧元素的原子可共同形成烃的含氧衍生物和某种常见无机阴离子碳酸氢根离子,醋酸与碳酸氢根离子反应,强酸制弱酸.
解答 解:(1)铝是13号元素,三个电子层,最外层电子数是3,所以是第三周期,第IIIA族元素,故答案为:第三; IIIA; 3;
(2)非金属性:N<O,所以氧元素对应氢化物稳定,故答案为:H2O;
(3)反应生成碳酸钠和氧气,反应中O元素的化合价既升高又降低,该反应及转移电子数为 ,
,
故答案为: ;
;
(4)醋酸与碳酸氢根离子反应,强酸制弱酸,离子方程式为:HCO3-+CH3COOH→CH3COO-+CO2 ↑+H2O,故答案为:HCO3-+CH3COOH→CH3COO-+CO2↑+H2O;
点评 本题考查性质结构位置关系应用,为高频考点,涉及化学方程式中常用化学用语、元素周期律、元素在周期表中的位置等,题目难度中等.

练习册系列答案
相关题目
18.已知反应:
①101KPa时,2C(s)+O2(g)=2CO(g);△H=-221KJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol
下列结论正确的是( )
①101KPa时,2C(s)+O2(g)=2CO(g);△H=-221KJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热等于110.5KJ/mol | |
| B. | 2C(s)+2O2(g)=2CO2(g);△H>-221 KJ/mol | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热为-57.3 KJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 KJ |
15.一定温度下,在一固定体积的密闭容器中,可逆反应A(s)+3B(g)?2C(g)达到平衡时,下列说法正确的是( )
①C的生成速率和C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化 ④混合气体的总压强不再变化 ⑤A、B、C物质的量之比为1:3:2
⑥混合气体的平均相对分子质量不变 ⑦容器中C的体积分数不变.
①C的生成速率和C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化 ④混合气体的总压强不再变化 ⑤A、B、C物质的量之比为1:3:2
⑥混合气体的平均相对分子质量不变 ⑦容器中C的体积分数不变.
| A. | ②④⑤⑦ | B. | ①③④⑥⑦ | C. | ①④⑥⑦ | D. | ①③④⑤ |
2.一定温度下,反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志( )
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2 | |
| D. | 单位时间里每增加1 mol N2,同时增加3 mol H2 |
12.能量之间是可以相互转化的.下列过程中,有电能转化为化学能的是( )
| A. | 电解水 | B. | 光合作用 | C. | 打手机 | D. | 点燃氢气 |
19.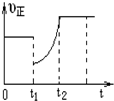 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A 和n mol B,A、B的转化率均不变 | |
| D. | 图象中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度 |
16.下列各组离子,一定能在指定环境中大量共存的是( )
| A. | pH=0的溶液中:K+、ClO-、CH3CHO、SO42- | |
| B. | c(H+)=10-12mol•L-1的溶液中:Na+、NH4+、Cl-、Br- | |
| C. | 加人KSCN显血红色的溶液中:Br-、NO3-、SO42-、Mg2+ | |
| D. | 在加入Al能放出大量H2的溶液中:NH4+、SO42-、C1-、HCO3- |

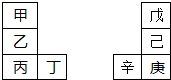 甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,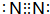 ,写出一种含戊、己两种元素的离子化合物的化学式(NH4)3PO4或(NH4)2HPO4、NH4H2PO4.
,写出一种含戊、己两种元素的离子化合物的化学式(NH4)3PO4或(NH4)2HPO4、NH4H2PO4.