题目内容
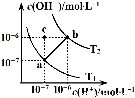
如图表示水溶液中c(H+)和c(OH-)的关系,下列说法正确的是( )
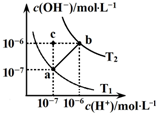

| A、ab线上任意点溶液均显中性 | B、b点时,溶液的pH=6,显酸性 | C、图中温度T1>T2 | D、在水中通入适量HCl气体可从a点变到c点 |
分析:A、ab线上任意点,溶液溶液中氢离子与氢氧根离子浓度相等;
B、b点时,c(H+)=c(OH-)=1×10-6mol/L,溶液的pH=6,溶液显示中性;
C、水的电离为吸热反应,温度越高,水的电离程度越大;
D、加入氯化氢气体,溶液中氢离子浓度增大,氢氧根离子浓度减小,溶液显示酸性,而c点为碱性.
B、b点时,c(H+)=c(OH-)=1×10-6mol/L,溶液的pH=6,溶液显示中性;
C、水的电离为吸热反应,温度越高,水的电离程度越大;
D、加入氯化氢气体,溶液中氢离子浓度增大,氢氧根离子浓度减小,溶液显示酸性,而c点为碱性.
解答:解:A、ab线上任意点,c(H+)=c(OH-),溶液一定显示中性,故A正确;
B、b点时,c(H+)=c(OH-)=1×10-6mol/L,溶液的pH=6,由于氢离子与氢氧根离子浓度相等,所以溶液显示中性,故B错误;
C、T1时纯水中水电离的氢离子浓度为c(H+)=c(OH-)=1×10-7mol/L,T2时纯水中水电离的氢离子浓度为c(H+)=c(OH-)=1×10-6mol/L,显然T2时水的电离程度较大,所以温度T1<T2,故C错误;
D、在c点c(H+)=1×10-7mol/L,c(OH-)=1×10-6mol/L,溶液显示碱性,所以加入氯化氢后溶液不可能显示碱性,故D错误;
故选A.
B、b点时,c(H+)=c(OH-)=1×10-6mol/L,溶液的pH=6,由于氢离子与氢氧根离子浓度相等,所以溶液显示中性,故B错误;
C、T1时纯水中水电离的氢离子浓度为c(H+)=c(OH-)=1×10-7mol/L,T2时纯水中水电离的氢离子浓度为c(H+)=c(OH-)=1×10-6mol/L,显然T2时水的电离程度较大,所以温度T1<T2,故C错误;
D、在c点c(H+)=1×10-7mol/L,c(OH-)=1×10-6mol/L,溶液显示碱性,所以加入氯化氢后溶液不可能显示碱性,故D错误;
故选A.
点评:本题考查了水的电离及影响因素,题目难度不大,注意明确影响水的电离的因素,明确溶液酸碱性取决于溶液中氢离子与氢氧根离子的浓度大小,不能以溶液的pH判断溶液酸碱性.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
下列是A、B、C、D、E五中元素的某些性质:
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3 杂化方式的是
A.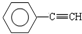 B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物水溶液中存在的所有氢键 .
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是 (写分子式),理由是 ;
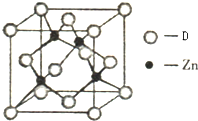
(4)如图表示某种元素D与锌形成的化合物晶胞,其中Zn和D通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 .
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
A.
 B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3(2)用氢键表示式写出E的氢化物水溶液中存在的所有氢键
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是
(4)如图表示某种元素D与锌形成的化合物晶胞,其中Zn和D通过共价键结合,该化合物的化学式为

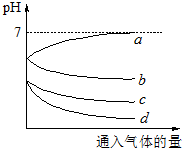 (2013?闵行区二模)向等体积等物质的量浓度的H2S和SO2的水溶液各两份中,分别通入不同的气体,一段时间后,如图表示通入的气体的量与溶液pH关系的曲线图,下列说法中正确的是( )
(2013?闵行区二模)向等体积等物质的量浓度的H2S和SO2的水溶液各两份中,分别通入不同的气体,一段时间后,如图表示通入的气体的量与溶液pH关系的曲线图,下列说法中正确的是( ) 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围: