题目内容
已知下列物质氧化H2SO3时,自身发生如下变化:Cl2→2Cl-,MnO4-→Mn2+,Cr2O72-→2Cr3+,H2O2→2H2O.如果分别用等物质的量的这些物质氧化足量的H2SO3,得到H2SO4最多的是( )
| A.Cr2O72- | B.Cl2 | C.MnO4- | D.H2O2 |
假设氧化剂的物质的量均是1mol,则在Cl2→2Cl-中,1molCl2可得2mol电子,在MnO4-→Mn2+中,1molMnO4-得5mol电子,在Cr2O72-→2Cr3+中,1molCr2O72-得6mol电子,在H2O2→2H2O中,1molH2O2得2mol电子,所以应该选择Cr2O72-,因为1molCr2O72-得到6mol电子,是这四个中最多的,因此被氧化的亚硫酸最多,得到H2SO4最多.
故选A.
故选A.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
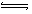 CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。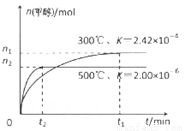
 CH3OH+H2O。
CH3OH+H2O。
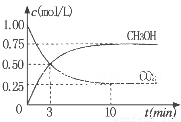
 CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60
molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1
=2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60
molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1
=2.2,则该条件下CH3OH 的平衡转化率为______ 。

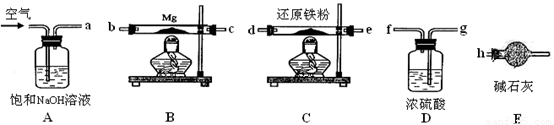
 MgO+H2↑ Mg3N2
+6H2O = 3Mg(OH)2+2NH3↑
MgO+H2↑ Mg3N2
+6H2O = 3Mg(OH)2+2NH3↑