题目内容
反应2SO2(g)+O2(g) 2SO3(g)在一密闭容器中进行。已知初始浓度 c0(SO2)=0.4mol?L-1、c0(O2)=1mol?L-1,如达到平衡时有80%的SO2转化为SO3,求平衡时三种气体的浓度和平衡常数。
2SO3(g)在一密闭容器中进行。已知初始浓度 c0(SO2)=0.4mol?L-1、c0(O2)=1mol?L-1,如达到平衡时有80%的SO2转化为SO3,求平衡时三种气体的浓度和平衡常数。
解析: 2SO2(g) + O2(g)
 2SO3(g)
2SO3(g)初始浓度/mol?L-1 0.4 1 0
转化浓度/mol?L-1 0.4×80% 0.4×80%×1/2 0.4×80%
平衡浓度/mol?L-1 0.08 0.84 0.32
Kc=
 =19mol-1?L
=19mol-1?L【试题分析】

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
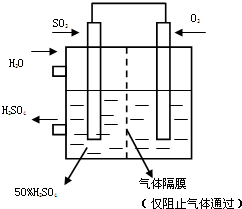
 (2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:
(2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:

 2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )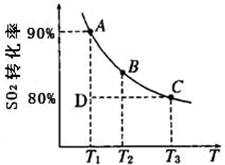 硫及其化合物在国民生产中占有重要的地位.
硫及其化合物在国民生产中占有重要的地位.
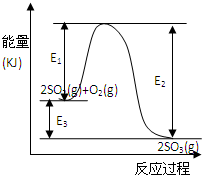 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.