题目内容
下列液体均处于25 ℃,有关叙述正确的是( )。
A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐
B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍
C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同
C
【解析】 本题考查了溶液中离子浓度的大小比较、溶解度等知识,意在考查考生对电解质溶液、电离与水解平衡等知识的理解能力。碱性溶液可能是碱、强碱弱酸盐的溶液,也可能是弱酸弱碱盐的溶液,A项错。pH是溶液中H+浓度的负对数,pH相差2个单位,c(H+)相差100倍,pH=4.5的H2SO4溶液中c(H+)是pH=6.5的牛奶中c(H+)的100倍,B项错。pH=3的醋酸溶液的物质的量浓度大于pH=11的NaOH溶液的物质的量浓度,两者等体积混合时醋酸过量,溶液呈酸性,溶液中各离子浓度关系正确,C正确;溶液中Cl-浓度影响AgCl的溶解度,等浓度的CaCl2溶液和NaCl溶液中Cl-浓度不同,AgCl的溶解度不同,D项错。

CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
实验 编号 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 |
| 0.15 |
(1)开展实验1和实验2的目的是______________________________。
(2)180 ℃时,反应到40 min,体系________(填“是”或“否”)达到平衡状态,理由是__________________________;
CH4的平衡转化率为________。
(3)已知130 ℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
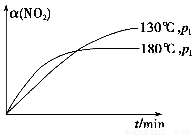
(4)一定条件下,反应时间t与转化率α(NO2)的关系如图所示,请在图像中画出180 ℃时,压强为p2(设压强p2>p1)的变化曲线,并做必要的标注。
(5)根据已知求算:ΔH2=________。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2



