题目内容
(2013·广东中山一模,11)下列依据热化学方程式得出的结论正确的是(双选)( )。
| A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b |
| D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
BD
燃烧热要求生成稳定的物质,其中水应为液态,故A错误;B中由于醋酸是弱酸,和NaOH中和时要电离而吸热,放出的热量小于57.3 kJ,故B正确;放热反应中ΔH<0,则a<b,故C错误;石墨转变为金刚石是吸热反应,能量升高,稳定性减弱,故D正确。

练习册系列答案
相关题目

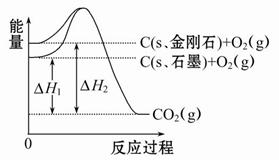
 表示的是
表示的是