题目内容
锂电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(-种炭黑)、铝箔以及有机粘接剂.某回收工艺流程如下:
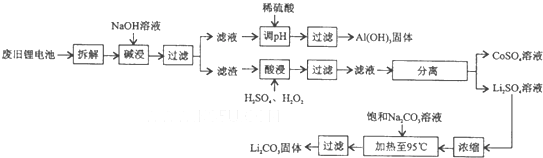
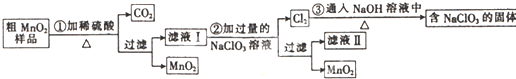
(1)根据上述工艺流程图得出:可回收到的产物除了有LiCO3,还有 、 ;
(2)锂电池使用广泛的主要原因是 ;
(3)废旧电池可能由于放电不完全而残留单质锂,为了安全生产,对拆解环境的要求是 ;
(4)碱浸时主要反应的化学方程式为 .

(1)根据上述工艺流程图得出:可回收到的产物除了有LiCO3,还有
(2)锂电池使用广泛的主要原因是
(3)废旧电池可能由于放电不完全而残留单质锂,为了安全生产,对拆解环境的要求是
(4)碱浸时主要反应的化学方程式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:废旧锂电池拆解后碱浸过滤得到滤渣酸浸,加入过氧化氢氧化剂氧化钴离子,过滤得到滤液分离得到硫酸钴溶液和硫酸锂溶液,硫酸锂如浓缩加入饱和碳酸钠溶液接啊热至95°C,过滤得到碳酸锂固体;滤液加入稀硫酸调节溶液PH沉淀铝离子过滤得到固体氢氧化铝;
(1)根据工艺流程的最终产物可判断回收到的产物,应为Al(OH)3、CoSO4、Li2CO3;
(2)单位重量锂放电量最大;
(3)从金属锂的化学性质分析,锂为活泼金属;
(4)根据铝能和碱反应来写方程式;
(1)根据工艺流程的最终产物可判断回收到的产物,应为Al(OH)3、CoSO4、Li2CO3;
(2)单位重量锂放电量最大;
(3)从金属锂的化学性质分析,锂为活泼金属;
(4)根据铝能和碱反应来写方程式;
解答:
解:(1)根据上述工艺流程图得出:工艺流程的最终产物解:Al(OH)3、CoSO4、Li2CO3,可回收到的产物除了有LiCO3,还有:Al(OH)3、CoSO4,
故答案为:Al(OH)3,CoSO4;
(2)锂的摩尔质量为7 g?mol-1,摩尔质量较小,单位质量转移电子的物质的量多放电量大,单位重量锂放电量最大;
故答案为:单位重量锂放电量最大;
(3)金属锂性质活泼,易与氧气、水发生反应,对拆解环境的要求是应隔绝空气和水分,故答案为:隔绝空气和水分;
(4)碱浸时主要反应是铝能与碱反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:Al(OH)3,CoSO4;
(2)锂的摩尔质量为7 g?mol-1,摩尔质量较小,单位质量转移电子的物质的量多放电量大,单位重量锂放电量最大;
故答案为:单位重量锂放电量最大;
(3)金属锂性质活泼,易与氧气、水发生反应,对拆解环境的要求是应隔绝空气和水分,故答案为:隔绝空气和水分;
(4)碱浸时主要反应是铝能与碱反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
点评:本题为生产流程题,涉及金属的回收、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,难度中等.

练习册系列答案
相关题目
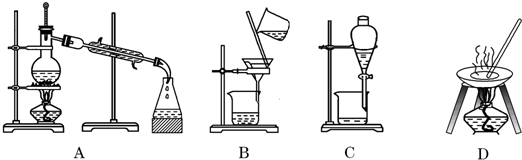
如图中所示的实验方法、装置或操作完全正确的是( )
A、 实验室制乙烯 |
B、 分离苯酚和水 |
C、 石油的蒸馏 |
D、 实验室制乙酸乙酯 |
下列叙述中正确的是( )
| A、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| B、为了确认实验桌上标明为蔗糖和NaCl的两瓶化学药品中的实物与标签名称是否相符,可各取少量放在口里品尝一下 |
| C、“沙里淘金”利用的是金与沙的密度相差较大 |
| D、实验剩余的药品不要随意丢弃,应放回原瓶 |
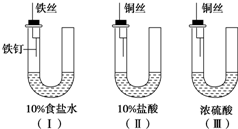 某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )
某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )| A、装置Ⅰ的U形管铁钉一侧的液面一定会上升 |
| B、装置Ⅱ中的铁钉腐蚀最严重 |
| C、比较U形管铁钉一侧的液面:装置Ⅰ比装置Ⅱ的低 |
| D、装置Ⅲ中的铁钉几乎没有被腐蚀 |
某溶液中有Cu2+、Al3+、SO42-和M离子,其物质的量之比为2:1:3:1,则M可能是( )
| A、Na+ |
| B、H+ |
| C、Cl- |
| D、OH- |