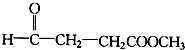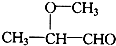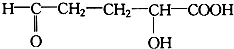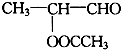题目内容
3.现有如下两个反应:(A)NaOH+HCl=NaCl+H2O(B)2FeCl3+Cu=2FeCl2+CuCl2(1)以上两个反应能设计成原电池的是B.
(2)如果不能,说明其原因A的反应为非氧化还原反应,没有电子转移.
(3)如果可以,则写出正、负极电极反应式:正极反应为2Fe3++2e-=2Fe2+、负极反应为Cu-2e-=Cu2+.
分析 自发进行的放热的氧化还原反应能设计成原电池;2FeCl3+Cu=2FeCl2+CuCl2中,Cu失电子发生氧化反应作负极、不如Cu活泼的金属或导电的非金属作正极,得电子的电解质氯化铁为电解质,以此来解答.
解答 解:(1)A中没有元素的化合价变化,为非氧化还原反应,不能设计成原电池,而B中Cu、Fe元素的化合价变化,为放热的氧化还原反应,可设计成原电池,故答案为:B;
(2)A的反应为非氧化还原反应,没有电子转移,则不能,故答案为:A的反应为非氧化还原反应,没有电子转移;
(3)2FeCl3+Cu=2FeCl2+CuCl2中,正极为碳棒,正极反应为2Fe3++2e-=2Fe2+,Cu失电子发生氧化反应作负极,负极反应为Cu-2e-=Cu2+,故答案为:正极反应为2Fe3++2e-=2Fe2+、负极反应为Cu-2e-=Cu2+.
点评 本题考查原电池的设计,为高频考点,把握原电池与氧化还原反应的关系、电极反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
13.有机化合物与我们的生活息息相关,下列说法正确的是( )
| A. | 甲苯的硝化、油脂的皂化均可看作取代反应 | |
| B. | 蛋白质水解生成葡萄糖放出热量,提供生命活动的能量 | |
| C. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 | |
| D. | 棉花和合成纤维的主要成分是纤维素 |
18.下列各组物质,用一种试剂无法区别的是( )
| A. | 三种浓酸:HNO3、H2SO4、HCl | |
| B. | 四种无色溶液:(NH4)2SO4、NH4Cl、Na2SO4、NaCl | |
| C. | 四种黑色粉末:FeO、Fe、CuO、C | |
| D. | 四种无色溶液:KCl、NaOH、K2SO4、NaNO3 |
8.下列各组物质混合后,不能生成NaOH的是( )
| A. | Na和H2O | B. | NaCl和H2O | ||
| C. | Na2O2和H2O | D. | Na2CO3溶液和Ca(OH)2溶液 |
15.含有非极性键的共价化合物是( )
| A. | Na2O2 | B. | H2O2 | C. | H2 | D. | HCl |
12.在一定条件下,某密闭容器中进行反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g).反应开始时NH3的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,容器体积不变,在这20s内H2O的化学反应速率为( )
4NH3(g)+5O2(g)?4NO(g)+6H2O(g).反应开始时NH3的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,容器体积不变,在这20s内H2O的化学反应速率为( )
| A. | 0.04 mol/(L•s) | B. | 0.06 mol/(L•s) | C. | 0.6 mol/(L•s) | D. | 0.8 mol/(L•s) |
13.一定质量的下列各组物质的混合物,不管两者以何种质量比混合,充分燃烧后所生成的H2O的质量都相等,该混合物可能是( )
| A. | 乙醇和乙烯 | B. | 甲醛和葡萄糖 | C. | 乙烯和乙酸乙酯 | D. | 丙烷和乙醛 |
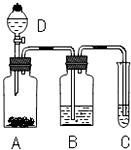 某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了实验装置:回答下列问题:
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了实验装置:回答下列问题: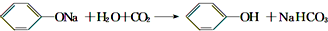 .
.