题目内容
9.(1)、把10.6g Na2CO3溶于水,配成2L溶液,那么Na2CO3物质的量浓度是多少?(2)、向此Na2CO3溶液滴加足量盐酸溶液,能生成多少克CO2气体?
(3)、生成的CO2气体在标准状况下体积为多少?
分析 (1)根据公式c=$\frac{n}{V}$计算物质的量浓度;
(2)向此Na2CO3溶液滴加足量盐酸溶液,产生二氧化碳、氯化钠和水,根据碳元素守恒来计算;
(3)根据公式V=nVm来计算气体的体积.
解答 解:(1)把10.6g Na2CO3溶于水,配成2L溶液,那么Na2CO3物质的量浓度c=$\frac{\frac{10.6g}{106g/mol}}{2L}$=0.05mol/L,答:Na2CO3物质的量浓度是0.05mol/L;
(2)向此Na2CO3溶液滴加足量盐酸溶液,能生成CO2的物质的量和碳酸钠的物质的量是相等的,都是0.1mol,所以产生二氧化碳的质量m=0.1mol×44g/mol=4.4g,答:能生成4.4克CO2气体;
(3)生成的CO2气体在标准状况下体积为V=nVm=0.1mol×22.4L/mol=2.24L,答:生成的CO2气体在标准状况下体积为2.24L.
点评 本题考查学生化学方程式中物质的量的有关计算知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
17.下列做法正确的是( )
| A. | 用手接触药品 | B. | 用嘴吹熄酒精灯火焰 | ||
| C. | 点燃氢气前一定要检验氢气的纯度 | D. | 将带有溶液的滴管平放在实验台上 |
4.下列关于混合物分离的方法中,能够分离汽油和水的是( )
| A. | 分液 | B. | 萃取 | C. | 蒸馏 | D. | 过滤 |
14.在常温下,发生下列几种反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O
②2A2++B2=2A3++2B-
③2B-+Z2=B2+2Z-
根据上述反应,判断下列结论错误的是( )
①16H++10Z-+2XO4-=2X2++5Z2+8H2O
②2A2++B2=2A3++2B-
③2B-+Z2=B2+2Z-
根据上述反应,判断下列结论错误的是( )
| A. | ①中X2+是氧化产物 | B. | 还原性强弱的顺序为:Z->A2+ | ||
| C. | 氧化性强弱的顺序为:XO4->B2 | D. | 溶液中可发生:Z2+2A2+=2A3++2Z- |
5.高铁酸盐在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
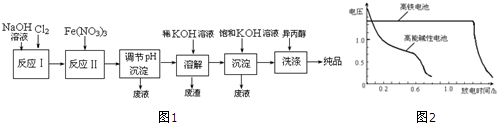
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图1所示:
①实验室制备Cl2的化学方程式为MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②反应I的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
③湿法制备高铁酸盐的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,能吸附水中悬浮物质形成沉淀,从而净化水.
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.其正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-阴极的电极反应式为Zn(OH)2+2e-=Zn+2OH-
如图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定.
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①实验室制备Cl2的化学方程式为MnO2+4HCl(浓盐酸)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②反应I的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O.
③湿法制备高铁酸盐的离子方程式为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,能吸附水中悬浮物质形成沉淀,从而净化水.
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
(4)高铁电池是可充电电池,其反应为3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.其正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-阴极的电极反应式为Zn(OH)2+2e-=Zn+2OH-
如图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定.


 .
.