题目内容
147g H2SO4的物质的量是 ,其中含有 mol H,含氧原子数为 个.
考点:物质的量的相关计算
专题:
分析:根据n=
计算硫酸的物质的量,氢原子物质的量为硫酸的2倍,氧原子物质的量为硫酸的4倍,根据N=nNA计算氧原子数目.
| m |
| M |
解答:
解:147g H2SO4的物质的量是
=1.5mol,其中含有氢原子物质的量为1.5mol×2=3mol,含有氧原子数为1.5mol×4×6.02×1023mol-1=3.612×1024,
故答案为:1.5 mol;3; 3.612×1024.
| 147g |
| 98g/mol |
故答案为:1.5 mol;3; 3.612×1024.
点评:本题考查物质的量有关计算,题目基础性,贴近教材,有利于基础知识的巩固.

练习册系列答案
相关题目
同样条件下,将Mg、Al、Fe分别投入质量相等且足量的稀H2SO4中,反应结束后三种溶液的质量相等,则投入Mg、Al、Fe的质量关系为( )
| A、Mg>Al>Fe |
| B、Mg<Al<Fe |
| C、Fe>Mg>AL |
| D、Fe<Mg<Al |
只能表示一个化学反应的离子方程式的是( )
| A、Cu(OH)2+2HCl═CuCl2+2H2O Cu(OH)2+2H+═Cu2++2H2O |
| B、FeSO4+Ba(OH)2═Fe(OH)2↓+BaSO4↓ Fe2++SO42-+Ba2++2OH-═Fe(OH)2↓+BaSO4↓ |
| C、Ba(OH)2+H2SO4═BaSO4↓+2H2O Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| D、2HCl+Fe(OH)2═Fe2++2H2O 2H++Fe(OH)2═Fe2++2H2O |
下列关于燃烧热的说法中正确的是( )
A、 |
B、 |
C、 |
D、 |
向氢氧化铁溶胶中逐滴加入一种液体,首先使溶胶发生凝聚而沉淀,继续加入使沉淀消失,这种液体是( )
| A、蒸馏水 |
| B、0.5 mol?L-1硫酸镁溶液 |
| C、0.5 mol?L-1氯化钾溶液 |
| D、0.5 mol?L-1盐酸 |
下列情况对中和滴定结果无影响的是( )
| A、盛待测液的锥形瓶滴定前用待测液润洗 |
| B、滴定管尖嘴部分在滴定前有气泡,滴定后气泡消失 |
| C、滴定到达终点时,视线高于滴定管内凹液面的最低点读数 |
| D、滴定管在滴定前未将液面调至“0”刻度除,而是在“2.40”刻度处 |
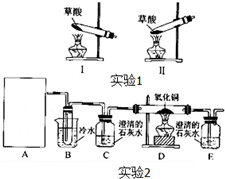 菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.
菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.