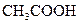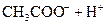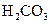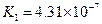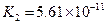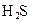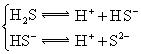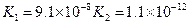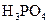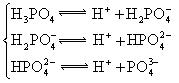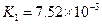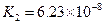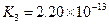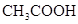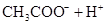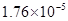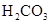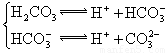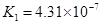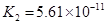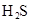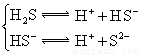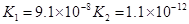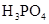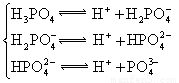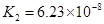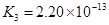题目内容
B.强酸pH=a,加水稀释到10n倍,则pH<
C.强碱pH=b,加水稀释到10n倍,则pH=b-n
D.弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n<7)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是25℃时几种常见弱酸的电离平衡常数
| 酸 | 电离方程式 | 电离平衡常数K |
| | | |
| | | |
| | | |
| | | |
回答下列各问:
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”、“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?__________________.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,对于H3PO4此规律是________________,产生此规律的原因是_________________________.
![]() (5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH- 已知0.10 mol·L-1NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
(5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH- 已知0.10 mol·L-1NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
①用pH试纸测量溶液的pH值,即可求得C平衡(OH-),测定溶液pH值的操作是______________。
②测量C平衡(NH3∙H2O)的方法最好用_____________法(填方法名称)
③求此温度下该反应的平衡常数K.(写出计算过程,计算结果保留2位有效数字)
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是25℃时几种常见弱酸的电离平衡常数
|
酸 |
电离方程式 |
电离平衡常数K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
回答下列各问:
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”、“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?__________________.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,对于H3PO4此规律是________________,产生此规律的原因是_________________________.
 (5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH-
已知0.10 mol·L-1
NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
(5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH-
已知0.10 mol·L-1
NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
①用pH试纸测量溶液的pH值,即可求得C平衡(OH-),测定溶液pH值的操作是______________。
②测量C平衡(NH3∙H2O)的方法最好用_____________法(填方法名称)
③求此温度下该反应的平衡常数K.(写出计算过程,计算结果保留2位有效数字)