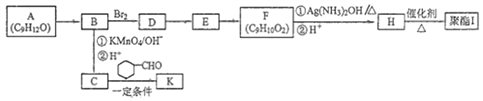
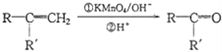ЬтФПФкШн
ЁОЬтФПЁПФГЭЌбЇРћгУШчЯТЪЕбщзАжУжЦБИЩйСПЕФЦЏАзЗлЁЃЛиД№ЯТСаЮЪЬтЃК
(1)ЦЏАзЗлЕФгааЇГЩЗжЪЧ__________________ЃЈЬюЛЏбЇЪНЃЉЁЃ
(2)вЧЦїaЕФУћГЦЪЧ____________ЃЌгУЖўбѕЛЏУЬКЭХЈбЮЫсжЦШЁТШЦјЕФЛЏбЇЗНГЬЪНЮЊMnO2 + 4HCl ЃЈХЈЃЉ![]() MnCl2 + Cl2 Ёќ+ 2H2O ИУЗДгІжабѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ ________________ЁЃ
MnCl2 + Cl2 Ёќ+ 2H2O ИУЗДгІжабѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ ________________ЁЃ
(3)зАжУBЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________________________________ЁЃ
(4)зАжУCЕФзїгУЪЧ___________ЃЌCжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ_______________________________ЁЃ
ЁОД№АИЁПCa(ClO)2 ЗжвКТЉЖЗ 1:2 2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 +2H2O ЮќЪеЖргрЕФТШЦјЃЌЗРжЙЮлШОПеЦј 2OHЃ + Cl2 = ClOЃ + ClЃ + H2O
ЁОНтЮіЁП
(1)ЪЏЛвШщжаЭЈШы![]() жЦЕУЦЏАзЗлЃЛ(2)ИљОнзАжУЭМЗжЮівЧЦїaЕФУћГЦЃЛИљОнЛЏКЯМлЕФБфЛЏХаЖЯбѕЛЏМСЁЂЛЙдМСЃЛ(3)зАжУBжаЪЏЛвШщгыТШЦјЗДгІЩњГЩТШЛЏИЦКЭДЮТШЫсИЦЁЂЫЎЃЛ(4)ТШЦјгаЖОЃЌашвЊЮВЦјДІРэЃЛТШЦјгыЧтбѕЛЏФЦЗДгІЩњГЩТШЛЏФЦКЭДЮТШЫсФЦЁЂЫЎЁЃ
жЦЕУЦЏАзЗлЃЛ(2)ИљОнзАжУЭМЗжЮівЧЦїaЕФУћГЦЃЛИљОнЛЏКЯМлЕФБфЛЏХаЖЯбѕЛЏМСЁЂЛЙдМСЃЛ(3)зАжУBжаЪЏЛвШщгыТШЦјЗДгІЩњГЩТШЛЏИЦКЭДЮТШЫсИЦЁЂЫЎЃЛ(4)ТШЦјгаЖОЃЌашвЊЮВЦјДІРэЃЛТШЦјгыЧтбѕЛЏФЦЗДгІЩњГЩТШЛЏФЦКЭДЮТШЫсФЦЁЂЫЎЁЃ
(1)ЪЏЛвШщжаЭЈШы![]() жЦЕУЦЏАзЗлЃЌЦЏАзЗлЕФжївЊГЩЗжЪЧCa(ClO)2ЁЂCaCl2ЃЌгааЇГЩЗжЪЧCa(ClO)2ЃЛ(2)ИљОнзАжУЭМЃЌвЧЦїaЕФУћГЦЪЧЗжвКТЉЖЗЃЛИУЗДгІжаЃЌMnO2 ЁњMnCl2ЃЌMnдЊЫигЩ+4МлЁњ+2МлЃЌЕУ2ИіЕчзгЃЌЫљвдMnO2ЪЧбѕЛЏМСЃЛ HClЃЈХЈЃЉЁњCl2ЃЌClдЊЫигЩ-1МлЁњ0МлЃЌЪЇЕчзгЃЌЫљвд HClЪЧЛЙдМСЃЛHClЁњMnCl2ЃЌClдЊЫиЕФЛЏКЯМлУЛБфЛЏЃЌЫљвдHClзїЫсВЮМгЗДгІЃЌЫљвдбѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЪЧ1ЃК2ЃЛ(3)зАжУBжаЪЏЛвШщгыТШЦјЗДгІЩњГЩТШЛЏИЦКЭДЮТШЫсИЦЁЂЫЎЃЌЗДгІЗНГЬЪНЪЧ2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 +2H2OЃЛ(4)ТШЦјгаЖОЃЌПЩвдгУЧтбѕЛЏФЦШмвКЮќЪеЃЌзАжУCЕФзїгУЪЧЮќЪеЖргрЕФТШЦјЃЌЗРжЙЮлШОПеЦјЃЌCжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ2OHЃ + Cl2 = ClOЃ + ClЃ + H2OЁЃ
жЦЕУЦЏАзЗлЃЌЦЏАзЗлЕФжївЊГЩЗжЪЧCa(ClO)2ЁЂCaCl2ЃЌгааЇГЩЗжЪЧCa(ClO)2ЃЛ(2)ИљОнзАжУЭМЃЌвЧЦїaЕФУћГЦЪЧЗжвКТЉЖЗЃЛИУЗДгІжаЃЌMnO2 ЁњMnCl2ЃЌMnдЊЫигЩ+4МлЁњ+2МлЃЌЕУ2ИіЕчзгЃЌЫљвдMnO2ЪЧбѕЛЏМСЃЛ HClЃЈХЈЃЉЁњCl2ЃЌClдЊЫигЩ-1МлЁњ0МлЃЌЪЇЕчзгЃЌЫљвд HClЪЧЛЙдМСЃЛHClЁњMnCl2ЃЌClдЊЫиЕФЛЏКЯМлУЛБфЛЏЃЌЫљвдHClзїЫсВЮМгЗДгІЃЌЫљвдбѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЪЧ1ЃК2ЃЛ(3)зАжУBжаЪЏЛвШщгыТШЦјЗДгІЩњГЩТШЛЏИЦКЭДЮТШЫсИЦЁЂЫЎЃЌЗДгІЗНГЬЪНЪЧ2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 +2H2OЃЛ(4)ТШЦјгаЖОЃЌПЩвдгУЧтбѕЛЏФЦШмвКЮќЪеЃЌзАжУCЕФзїгУЪЧЮќЪеЖргрЕФТШЦјЃЌЗРжЙЮлШОПеЦјЃЌCжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ2OHЃ + Cl2 = ClOЃ + ClЃ + H2OЁЃ

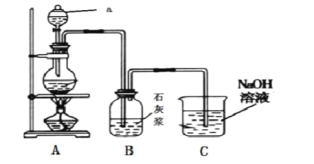
ЁОЬтФПЁПКЃЫЎЪЧвЛИіОоДѓЕФЛЏбЇзЪдДБІПтЃЌРћгУКЃЫЎПЩвдЛёЕУКмЖрЛЏЙЄВњЦЗЁЃ
ЃЈ1ЃЉКЃЫЎжажЦЕУЕФТШЛЏФЦПЩгУгкЩњВњЩеМюМАТШЦјЁЃЗДгІЕФРызгЗНГЬЪНЪЧ ЁЃ
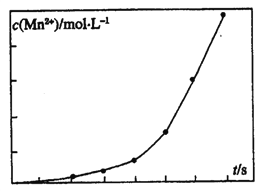
ЃЈ2ЃЉРћгУжЦбЮКѓЕФбЮТБЬсШЁфхЕФЙЄвеСїГЬШчЯТ(ВПЗжВйзїКЭЬѕМўвбТдШЅ)ЃК
![]()
НЋBr2гыNa2CO3ЗДгІЕФЛЏбЇЗНГЬЪНВЙГфЭъећЃК
![]()
ЃЈ3ЃЉбЮТБеєЗЂРфШДКѓЮіГіТБПщЕФжївЊГЩЗжЪЧMgCl2ЃЌДЫЭтЛЙКЌFe2ЃЋЁЂFe3ЃЋЁЂMn2ЃЋЕШРызгЁЃвдТБПщЮЊдСЯжЦЕУУОЕФЙЄвеСїГЬШчЯТ(ВПЗжВйзїКЭЬѕМўвбТдШЅ)ЃК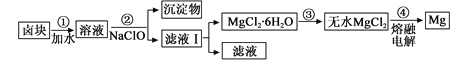
ЩњГЩЧтбѕЛЏЮяГСЕэЕФpH
ЮяжЪ | ПЊЪМГСЕэ | ГСЕэЭъШЋ |
Fe(OH)3 | 2ЃЎ7 | 3ЃЎ7 |
Fe(OH)2 | 7ЃЎ6 | 9ЃЎ6 |
Mn(OH)2 | 8ЃЎ3 | 9ЃЎ8 |
Mg(OH) 2 | 9ЃЎ6 | 11ЃЎ1 |
ЂйВНжшЂкжаашПижЦpH=9ЃЎ8ЃЌЦфФПЕФЪЧ ЁЃ
ЂкгУNaClO бѕЛЏFe2ЃЋЕУЕНFe(OH)3ГСЕэЕФРызгЗДгІЗНГЬЪНЪЧ ЁЃ
ЂлВНжшЂлашдкHClБЃЛЄЦјжаМгШШНјааЃЌЧыгУЛЏбЇЦНКтвЦЖЏдРэНтЪЭдвђ________ЁЃ
ЂмNaClOЛЙФмГ§ШЅбЮТБжаЕФCO(NH2)2ЃЌЩњГЩбЮКЭФмВЮгыДѓЦјбЛЗЕФЮяжЪЁЃГ§ШЅ0ЃЎ1mol CO(NH2)2ЪБЯћКФ
NaClO gЁЃ