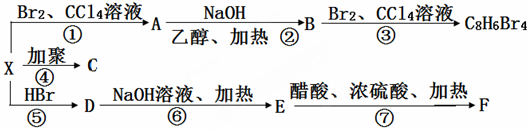
题目内容
4.下列说法正确的是( )| A. | 油脂在酸性条件下水解的反应称为皂化反应 | |
| B. | 煤的炼制方法中煤的气化和液化是物理方法,煤的干馏是化学方法 | |
| C. | 石油裂化的目的是提高轻质油的产量和质量 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 |
分析 A.油脂碱性条件下水解制备肥皂;
B.煤的气化和液化是化学变化;
C.石油裂化的目的是为了提高轻质液体燃料(汽油、煤油、柴油等)的产量;
D.加入饱和硫酸铵溶液,发生盐析.
解答 解:A.油脂碱性条件下水解制备肥皂,则油脂碱性条件下水解反应为皂化反应,故A错误;
B.煤的气化是让煤在高温条件下与水蒸气反应生成氢气和一氧化碳;煤的液化是利用煤制取甲醇的反应,故均为化学变化,故B错误;
C.石油裂化的目的是为了提高轻质液体燃料(汽油、煤油、柴油等)的产量,特别是提高汽油的产量,故C正确;
D.加入饱和硫酸铵溶液,发生盐析,而加入重金属盐、高温等可发生蛋白质的变性,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重油脂、蛋白质性质的考查,注意石油的综合利用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列离子组一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 由水电离出c(H+)=10-3 mol•L-1的溶液中:Na+、AlO2-、NO3-、HCO3- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
12.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A. | 生成42.0L N2(标准状况) | |
| B. | 有0.250mol KNO3被氧化 | |
| C. | 转移电子的物质的量为1.25mol | |
| D. | 被氧化的N原子的物质的量为3.0mol |
19.下列化学用语表述正确的是( )
| A. | Na的原子结构示意图: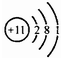 | B. | N2分子的结构式:N=N | ||
| C. | HC1的电子式: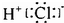 | D. | H2O分子的球棍模型: |
9.一定量的某有机物完全燃烧后,生成1mol CO2和9g H2O,该有机物可能是( )
| A. | C3H8 | B. | CH3CH2OH | C. | CH3CHO | D. | C2H2 |
16.下列排列顺序正确的是( )
| A. | 离子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
13.利用低品位软锰矿浆(主要成分是MnO2,少量的Fe3+、Al3+等)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体可实现资源的综合利用和环境治理.

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
(1)写出浸出过程中主要反应的化学方程式SO2+MnO2=MnSO4.浸出过程中Fe3+转化为Fe2+,此转化的离子反应方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7~8.3.
②若加入的石灰浆过多,会使得MnSO4•H2O晶体中含有较多杂质,用离子反应方程式表示其原因Al(OH)3+3OH-═AlO2-+2H2O或Al3++4OH-═AlO2-+2H2O.
(4)下列各组试剂中,能准确测定尾气中SO2含量的是b、c(选填序号).
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液.

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7~8.3.
②若加入的石灰浆过多,会使得MnSO4•H2O晶体中含有较多杂质,用离子反应方程式表示其原因Al(OH)3+3OH-═AlO2-+2H2O或Al3++4OH-═AlO2-+2H2O.
(4)下列各组试剂中,能准确测定尾气中SO2含量的是b、c(选填序号).
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液.
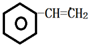 ,C的结构简式:
,C的结构简式: .
.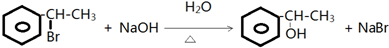 .
.