题目内容
2014年11月12日在北京发布了《中美气候变化联合声明》,碳捕获和封存技术成为了一个热点环境问题.
(1)燃烧前捕获是其中方法之一,以CH4燃烧为例,涉及反应如下:
①CH4(g)+H2O(g)=C0(g)+3H2(g)△H=-206.2KJ?mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g)△H=+2.8KJ?mol-1
则CH4(g)+2H2O(g)=C02(g)+4H2(g)△H= .
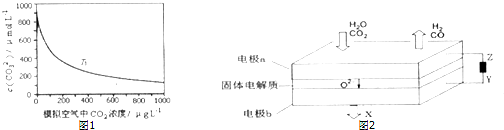
(2)某研究小组在实验室测得海水中CO32- 浓度与模拟空气中CO2浓度的关系曲线如图1.根据曲线的变化.可归纳出曲线变化的规律: .其它条件相同时,温度越高,海水中CO32-浓度越小,请在图中补充温度为T2时的曲线(T1<T2).
(3)250℃时,以Ni合金为催化剂,向1L容器中通入3molCO2、3molCH4.发生反应:CO2(g)+CH4(g)?2C0(g)+2H2(g).反应达到平衡时CO2的体积分数为10%,求该温度下该反应的平衡常数K(写出计算过程).
(4)高温电解技术可将释放的C02转化为具有工业利用价值的产品.反应方程式为CO2+H20
CO+H2+O2,其工作原理示意图如图2,电极b上放出的气体X为 ,电极b连接Y为电源的 极(填正、负).

(1)燃烧前捕获是其中方法之一,以CH4燃烧为例,涉及反应如下:
①CH4(g)+H2O(g)=C0(g)+3H2(g)△H=-206.2KJ?mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g)△H=+2.8KJ?mol-1
则CH4(g)+2H2O(g)=C02(g)+4H2(g)△H=
(2)某研究小组在实验室测得海水中CO32- 浓度与模拟空气中CO2浓度的关系曲线如图1.根据曲线的变化.可归纳出曲线变化的规律:
(3)250℃时,以Ni合金为催化剂,向1L容器中通入3molCO2、3molCH4.发生反应:CO2(g)+CH4(g)?2C0(g)+2H2(g).反应达到平衡时CO2的体积分数为10%,求该温度下该反应的平衡常数K(写出计算过程).
(4)高温电解技术可将释放的C02转化为具有工业利用价值的产品.反应方程式为CO2+H20
| ||
| 高温 |
考点:用盖斯定律进行有关反应热的计算,用化学平衡常数进行计算,物质的量或浓度随时间的变化曲线,电解原理
专题:
分析:(1)已知①CH4(g)+H2O(g)=C0(g)+3H2(g)△H=-206.2KJ?mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g)△H=+2.8KJ?mol-1
由盖斯定律:①-②得CH4(g)+2H2O(g)=C02(g)+4H2(g)据此计算;
(2)海水中存在2HCO3-?CO32-+CO2+H2O,根据平衡移动分析;其它条件相同时,温度越高,海水中CO32-浓度越小,T2时曲线在T1曲线下面;
(3)设CO2转化的浓度为xmol/L,利用三段式求出x,根据K=
计算;
(4)电极b氧离子失去电子发生氧化反应生成氧气,则b为阳极,与电源正极相连.
②CO2(g)+H2(g)=CO(g)+H2O(g)△H=+2.8KJ?mol-1
由盖斯定律:①-②得CH4(g)+2H2O(g)=C02(g)+4H2(g)据此计算;
(2)海水中存在2HCO3-?CO32-+CO2+H2O,根据平衡移动分析;其它条件相同时,温度越高,海水中CO32-浓度越小,T2时曲线在T1曲线下面;
(3)设CO2转化的浓度为xmol/L,利用三段式求出x,根据K=
| c2(CO)?c2(H2) |
| c(CO2)?c(CH4) |
(4)电极b氧离子失去电子发生氧化反应生成氧气,则b为阳极,与电源正极相连.
解答:
解:(1)已知①CH4(g)+H2O(g)=C0(g)+3H2(g)△H=-206.2KJ?mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g)△H=+2.8KJ?mol-1
由盖斯定律:①-②得CH4(g)+2H2O(g)=C02(g)+4H2(g)△H=-206.2KJ?mol-1-2.8KJ?mol-1=-209.0KJ?mol-1;
故答案为:-209.0KJ?mol-1;
(2)海水中存在2HCO3-?CO32-+CO2+H2O,CO2浓度增大,化学平衡向左移动,CO32-浓度降低,则其它条件相同时,随着模拟空气中CO2浓度增大,海水中CO32- 浓度变小;其它条件相同时,温度越高,海水中CO32-浓度越小,T2时曲线在T1曲线下面,则图象为 ;
;
故答案为:其它条件相同时,随着模拟空气中CO2浓度增大,海水中CO32- 浓度变小; ;
;
(3)设CO2转化的浓度为xmol/L,
CO2(g)+CH4(g)?2C0(g)+2H2(g).
开始浓度(mol/L):3 3 0 0
转化浓度(mol/L):x x 2x 2x
平衡浓度(mol/L):3-x 3-x 2x 2x
反应达到平衡时CO2的体积分数为10%,则
×100%=10%,解得x=2
则K=
=
=256;
答:该温度下该反应的平衡常数为256;
(4)电极b氧离子失去电子发生氧化反应生成氧气,所以电极b上放出的气体为O2,阴离子在阳极失电子,所以b为阳极,与电源正极相连;
故答案为:O2;正.
②CO2(g)+H2(g)=CO(g)+H2O(g)△H=+2.8KJ?mol-1
由盖斯定律:①-②得CH4(g)+2H2O(g)=C02(g)+4H2(g)△H=-206.2KJ?mol-1-2.8KJ?mol-1=-209.0KJ?mol-1;
故答案为:-209.0KJ?mol-1;
(2)海水中存在2HCO3-?CO32-+CO2+H2O,CO2浓度增大,化学平衡向左移动,CO32-浓度降低,则其它条件相同时,随着模拟空气中CO2浓度增大,海水中CO32- 浓度变小;其它条件相同时,温度越高,海水中CO32-浓度越小,T2时曲线在T1曲线下面,则图象为
 ;
;故答案为:其它条件相同时,随着模拟空气中CO2浓度增大,海水中CO32- 浓度变小;
 ;
;(3)设CO2转化的浓度为xmol/L,
CO2(g)+CH4(g)?2C0(g)+2H2(g).
开始浓度(mol/L):3 3 0 0
转化浓度(mol/L):x x 2x 2x
平衡浓度(mol/L):3-x 3-x 2x 2x
反应达到平衡时CO2的体积分数为10%,则
| 3-x |
| 3-x+3-x+2x+2x |
则K=
| c2(CO)?c2(H2) |
| c(CO2)?c(CH4) |
| 42×42 |
| 1×1 |
答:该温度下该反应的平衡常数为256;
(4)电极b氧离子失去电子发生氧化反应生成氧气,所以电极b上放出的气体为O2,阴离子在阳极失电子,所以b为阳极,与电源正极相连;
故答案为:O2;正.
点评:本题主要考查了综合利用CO2,涉及热化学反应、电化学、化学平衡影响因素和平衡常数的计算等,题目较为综合难度中等,把握盖斯定律、平衡常数的计算和电化学原理是解答的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
我国科学家制得了SiO2超分子纳米管,微观结构如图.下列叙述正确的是( )


| A、SiO2与干冰的晶体结构相似 |
| B、SiO2耐腐蚀,不与任何酸反应 |
| C、工业上用SiO2制备粗硅 |
| D、光纤主要成分是SiO2,具有导电性 |
下列有关实验装置进行的相应实验,不能达到实验目的是( )
A、 用装置制取氯气 |
B、 用装置除去氯气中的少量氯化氢和水蒸气 |
C、 用装置可证明Cl2的氧化性强于S |
D、 用装置可以完成“喷泉”实验 |
 将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积可能是( )
将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积可能是( )| A、2.1mL | B、2.4mL |
| C、3.6mL | D、4mL |
相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是( )
| A、C3H4和C2H6 |
| B、C3H6和C4H8O |
| C、C3H6O2和C3H8O |
| D、C3H8O和C4H6O2 |
下列关于苯酚的叙述中,不正确的是( )
| A、其浓溶液如果不慎沾在皮肤上,应立即用酒精擦洗 |
| B、其水溶液显强酸性,俗称石炭酸 |
| C、超过65℃可以与水以任意比互溶 |
| D、纯净的苯酚是无色晶体,在空气中易被氧化而呈粉红色 |
H2O(g)-→H2O(l)是一个放热过程,但不是化学反应,Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0,则下列关于该反应的叙述不正确的是( )
| A、该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变 |
| B、上述热化学方程式中的△H的值与反应物的用量无关 |
| C、该反应的化学能可以转化为电能 |
| D、反应物的总能量高于生成物的总能量 |
