题目内容
取相同体积(0.025L)的两份0.01 mol/L NaOH溶液,把其中一份放在空气中一段时间后,溶液的 pH值____(填增大、减小或不变),其原因是____。用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为VA,另一份消耗硫酸溶液的体积为VB,则:(1)以甲基橙为指示剂时,VA与VB的关系是____;(2)以酚酞为指示剂时,VA与VB的关系是____。
减小,因吸收CO2生成Na2CO3,使NaOH减少。(1)VA=VB(2)VA<VB
解析:
NaOH溶液放置于空气中,因NaOH会与空气中的CO2起反应,导致溶液中NaOH减少,故溶液的pH值减小。用H2SO4滴定Na2CO3溶液时,反应分两个阶段进行:①H++CO32-=HCO3-(此时溶液呈弱碱性);②HCO3-+H+=H2O+CO2↑(此是溶液呈弱酸性)滴定过程中,按哪种反应进行,取决于所选择的指示剂。(1)若用甲基橙作指示剂,因其变色范围为pH=3.1~4.4,滴定反应按②式进行,由关系式2NaOH~Na2CO3~H2SO4,可知:消耗H2SO4的量相等,故此时VA=VB。(2)若用酚酞作指示剂,因其变色范围为pH=8~</PGN0062B.TXT/PGN>10,滴定反应按①式进行,消耗H2SO4的量减少,故VA<VB。

练习册系列答案
相关题目
|
室温时取浓度相同的NaOH和HCl溶液,以2∶1体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 | |
| [ ] | |
A. |
0.05 mol/L |
B. |
0.03 mol/L |
C. |
0.02 mol/L |
D. |
0.50 mol/L |
近年在我国已经发生多起饮用水污染事件.城市生活污水、工业废水的大量排放是其主要原因.水中的 是含氮有机物分解的产物,其浓度的大小是水污染的标志之一.检测水中的
是含氮有机物分解的产物,其浓度的大小是水污染的标志之一.检测水中的 可用比色法,其步骤为:
可用比色法,其步骤为:
I.(1)配制标准溶液:称取O.30g NaNO2配成1000mL溶液A.该操作中所用到的玻璃仪器除烧杯、容量瓶外还有______.
(2)量取5.OO mL溶液A,稀释至1L,得溶液B.准确量取5.00mL溶液A应选用的计量仪器是______.
Ⅱ.配制标准色阶:取6只规格均为10mL的比色管,分别加入体积不等的溶液B,不足10mL,再加少许(约0.3g)氨基苯磺酸 ( )粉末,结果如下::
)粉末,结果如下::
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL | 0.0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
(1)比色法适于______组分的测定(填“常量”或“微量”).
(2)若水样显色后与色阶中的6号颜色相同,表明水样中含
 为______mg/L.(保留一位小数).
为______mg/L.(保留一位小数).(3)用NaNO2晶体直接配制溶液B的缺点是______.
(4)如果水样显色后比6号还深,应采取的措施是______.
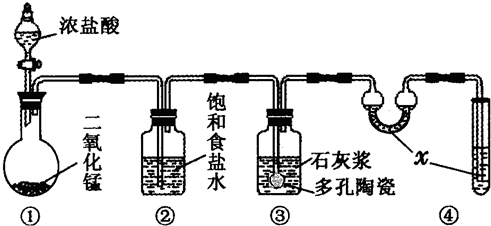
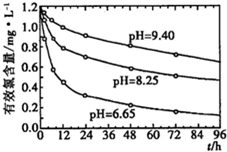
 科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。
科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。