题目内容
氢一氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:![]() +2OH-—2e-=2
+2OH-—2e-=2![]() 和
和![]()
![]() +
+![]() +2e-=2OH-,则下列叙述正确的是( )
+2e-=2OH-,则下列叙述正确的是( )
A. 通H2的一极是正极,通O2的一极是负极
B. 通O2的一极是正极,通H2的一极是负极
C. 工作是段时间后电解质溶液pH增大
D. 工作时负极区附近pH增大
答案:B
提示:
提示:
氢一氧燃料电池中通入H2的一极是负极,负极上2H2-4e-+4OH-=4H2O,消耗OH-使负极区pH变小;通入O2的一极是正极,正极点O2+4e-+2H2O=4OH-,又产生OH-使正极区pH增大。在整个装置中消耗的OH-与产生的OH-相等,故实际上KOH不消耗,总的反应是:2
|

练习册系列答案
相关题目
 AgOH+H+
AgOH+H+
 门上的固体材料R可以采用
门上的固体材料R可以采用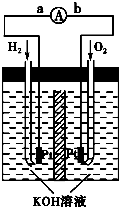 方向为
方向为 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.