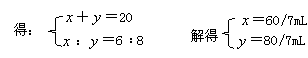题目内容
|
将20 mL NO2和NH3的混合气体,在一定条件下充分反应,化学方程式是:6NO2+8NH3 | |
A. |
3∶2 |
B. |
2∶3 |
C. |
3∶7 |
D. |
3∶4 |
答案:AC
解析:
解析:
|
设两气体恰好完全反应,则由反应方程式: 6NO2+8NH3 6 8 x y y-x≠2,故不可能是此种情况. ①若NO2过量,NH3完全反应,设 ②若NH3过量,NO2完全反应,设V(NO2)=y mL,则反应的NH3为(y+2)mL,应有y∶(y+2)=6∶8,解得y=6 mL,故V(NO2)∶V(NH3)=6∶14=3∶7 |

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
|
将20 mL NO2和NH3的混合气体,在一定条件下充分反应:6NO2+8NH3 | |
A. |
3∶2 |
B. |
2∶3 |
C. |
3∶7 |
D. |
3∶4 |
E. |
92∶61 |
|
常温常压下,将盛有20 mL NO2和O2的混合气体的大试管倒立在水槽中,水面上升至一定位置后不再变化,此时还有3 mL气体,则原混合气体中的NO2的体积是 | |
A. |
17.8 mL |
B. |
14.8 mL |
C. |
13.6 mL |
D. |
12.4 mL |