题目内容
向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c( B)未画出,t1时增大到0.05mol/L]。乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为 mol/L;
该反应的平衡常数表达式为K= 。
(2)若t5时改变的条件是升温,此时v(正) > v(逆),平衡常数K的值将 (选填“增大”、“减小”或“不变”)。
(3)若 t1= 15s,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=
mol/L·s。t3时改变的某一反应条件可能是 (选填序号)。
a.使用催化剂 b.增大压强 c.增大反应物浓度 d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式 。
(1)0.02 mol/L; (1分) K=[ B] ·[ C]2/ [ A]3(1分)
(2)增大 (1分)
(3)0.004mol/L·s (1分) ; a、 b (2分)
(4)3A (g)  2C(g) + B(g) -150akJ (2分)
2C(g) + B(g) -150akJ (2分)
解析试题分析:
(1)根据甲图物质的变化量之比,可知A、C的计量数之比为3:2 ,t4时改变的条件为减小压强,但平衡不移动,说明左右两边气体分子数相同,因此B为生成物,系数为1,则起始浓度0.02 mol/L; 平衡常数表达式为K=[ B] ·[ C]2/ [ A]3。
(2)升温平衡正移,说明反应正向吸热,平衡常数K的值增大。
(3)v(C)= △c(C)/ △t=0.004mol/L·s ; t3时改变的某一反应条件,正逆反应速率增大,平衡不移动,只有a、 b 符合。
(4)A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,减少3mol时:
3A (g)  2C(g) + B(g) -150akJ 。
2C(g) + B(g) -150akJ 。
考点:考查反应热、化学反应速率、化学平衡等相关知识。

常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_____________________________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。
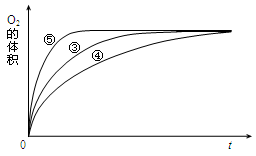
分析上图能够得出的实验结论是______________________________________。
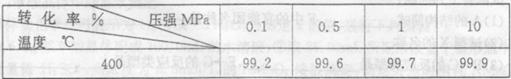
工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | ||
| 500 | 700 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | | |
请回答下列问题:
(1)反应②是 (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时V正 V逆(填“ > ”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是_____________(填序号)。
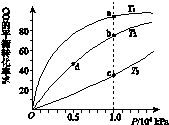
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c) , υ(b)>υ(d)
C.平衡常数:K(a)>K(c) , K(b)=K(d)
D.平均摩尔质量:M(a)>M(c) , M(b)>M(d)
(1)25 ℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
①在该温度时,取l mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是_______92.4 kJ。(填“小于”, “大于” 或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是_______________。
| A.NH3生成的速率与NH3分解的速率相等 |
B.混合气体的反应速率 v正(NH3)=v逆(H2) v正(NH3)=v逆(H2) |
| C.容器内的密度不再变化 |
| D.单位时间内消耗a mol N2,同时生成2a mol NH3 |
 值将_____(填“增大”, “减小” 或“不变”)。
值将_____(填“增大”, “减小” 或“不变”)。(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当PH=_________时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
 2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。
2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。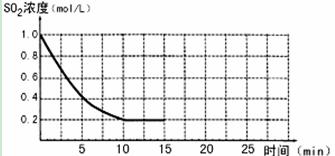
 pC达到平衡,若:
pC达到平衡,若:
 2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。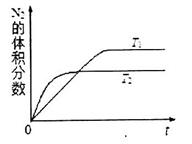
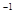 的醋酸与b mol
的醋酸与b mol L
L