��Ŀ����
ˮú������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã�
C (s) + H2O(g) ![]() CO (g) +H2 (g) ��H �� +131.3 kJ•mol��1
CO (g) +H2 (g) ��H �� +131.3 kJ•mol��1
��1���÷�Ӧ��ƽ�ⳣ��K���¶ȵ����߶�___________������ / ��С / ���䣩��
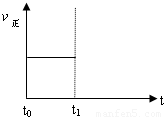
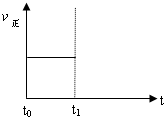
 ��2��������Ӧ��t0ʱ�̴ﵽƽ�⣨����ͼ��������t1ʱ�̸ı�ijһ������������ͼ�м�������t1ʱ��֮������Ӧ���ʣ���������ʱ��ı仯��
��2��������Ӧ��t0ʱ�̴ﵽƽ�⣨����ͼ��������t1ʱ�̸ı�ijһ������������ͼ�м�������t1ʱ��֮������Ӧ���ʣ���������ʱ��ı仯��
�� ��С�����������ʵ�߱�ʾ��
�� �����¶ȣ������߱�ʾ��
��3��һ���¶��£����������о�������������Ӧ����������̿�������������ʵ����ʵ���Ũ�ȼ����淴Ӧ���ʹ�ϵ���±���ʾ������д������Ӧ�Ŀո�
| ������� | c(H2O)/mol��L��1 | c(CO)/mol��L��1 | c(H2)/mol��L��1 | �����������Ƚ� |
| I | 0.06 | 0.60 | 0.10 | ����=���� |
| �� | 0.12 | 0.20 | ________ | ����=���� |
| �� | 0.10 | 0.20 | 0.40 | ����____���� |
��4����֪��2C (s) + O2(g) �� 2CO (g) ��H �� ��221.0 kJ��mo1��1
2CO(g) + O2(g) �� 2CO2 (g) ��H �� ��566.0 kJ��mo1��1
2H2 (g) + O2 (g) �� 2H2O (g) ��H �� ��483.6 kJ��mo1��1
����24g̿��ȫת��Ϊˮú����Ȼ���ٳ��ȼ�գ��������̵��ʱ�Ϊ��H �� kJ/mol��
��1������ ��1�֣�
 ��2����4�֣�
��2����4�֣�
����ռ2�֣����λ�á��������ơ��յ���ԭ���ߵ���Ըߵ͵�ֻҪ��һ���������0�֡���
��3����4�֣�
| 0.60��2�֣� | ||||
| ����_>_������2�֣� |
��4����787.0 ��2�֣����������ŵ�0�֣���Ч���ֲ�ȷ��1�֡���

 ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�C ��s��+H2O��g���TCO ��g��+H2 ��g����H=+131.3kJ?mol-1
��1���÷�Ӧ��ƽ�ⳣ��K���¶ȵ����߶�______������/��С/���䣩��
��2��������Ӧ�ﵽƽ�����ϵ�е�C��s��ȫ�����ߣ�ƽ��______��������/������/���ƶ�����
��3��������Ӧ��tʱ�̴ﵽƽ�⣨��ͼ��������t1ʱ�̸ı�ijһ������������ͼ�м�������t1ʱ��֮������Ӧ���ʣ���������ʱ��ı仯��
����С�����������ʵ�߱�ʾ��
�ڽ����¶ȣ������߱�ʾ��
��4��һ���¶��£����������о�������������Ӧ����������̿�������������ʵ����ʵ���Ũ�ȼ����淴Ӧ���ʹ�ϵ���±���ʾ������д������Ӧ�Ŀո�
| ������� | c��H2O��/mol?L-1 | c��CO��/mol?L-1 | c��H2��/mol?L-1 | �����������Ƚ� |
| I | 0.06 | 0.60 | 0.10 | ����=���� |
| �� | 0.12 | 0.20 | ______ | ����=���� |
| �� | 0.10 | 0.20 | 0.40 | ����______���� |
 ˮú������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã�
ˮú������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã�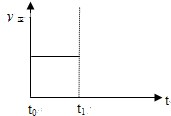 ��2009?����ģ�⣩ˮú������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã�
��2009?����ģ�⣩ˮú������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã� CO (g) +H2 (g) ��H�� +131.3 kJ?mol��1����������������
CO (g) +H2 (g) ��H�� +131.3 kJ?mol��1����������������