题目内容
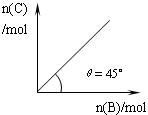
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g) 4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是
4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是
 4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是
4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是
| A.若保持压强一定,当温度升高后,则图中θ>45° |
| B.若再加入B,则再次达到平衡时正、逆反应速率均逐渐增大 |
| C.若保持压强一定,再加入B,则反应体系气体密度减小 |
| D.平衡时B的转化率为50% |
D
从图中可以看出,角度为45°,增加c的量等于增加B的量,即通入4molC,逆向反应,生成2molB,同时剩下2molC。反向同样成立(体积可变,恒压,等效平衡),故B的转化率为50%。升高温度平衡逆向移动,C的量减少,B的量增加,角度小于45°;加入B正反应速率增加,逆反应速率不变;压强一定加入B,密度增大。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
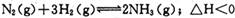 达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示。下列有关叙述一定正确的是
达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示。下列有关叙述一定正确的是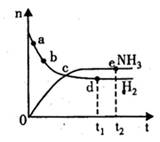
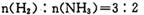
 x C(g)+2D(g)ΔH <0 ,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断:
x C(g)+2D(g)ΔH <0 ,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断: ① x值等于 ; ② B的平衡浓度为 。
① x值等于 ; ② B的平衡浓度为 。


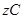 达到平衡:
达到平衡: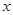 、y、z间的关系是________________;
、y、z间的关系是________________;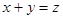 ,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动;
,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动;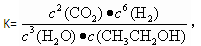 则对应的化学反应可以表示为:
则对应的化学反应可以表示为: CH3CH2OH(g) + 3H2O(g)
CH3CH2OH(g) + 3H2O(g) y C(g),如图表示在不同条件下反应物B的体积分数φ(B)随时间变化的关系,据此判断
y C(g),如图表示在不同条件下反应物B的体积分数φ(B)随时间变化的关系,据此判断
 Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6) ②NaUr(s)
Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6) ②NaUr(s)  Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq) 2CH3OH(g);△H=37kJ·mol-1,测得反应达到平衡时的有关数据如下:
2CH3OH(g);△H=37kJ·mol-1,测得反应达到平衡时的有关数据如下: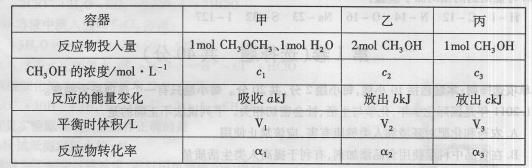
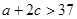
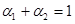
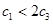
 容包括:化学平衡、电离平衡、水解平衡和
容包括:化学平衡、电离平衡、水解平衡和 4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c) (g)
(g)  与K
与K 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积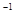 c0(O
c0(O
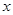 kJ·mol
kJ·mol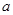 +b>
+b>