��Ŀ����
��4 mol SO3�����4 mol NO����2 L�����У�һ�������·������¿��淴Ӧ(������NO2��N2O4֮����ת��)��2SO3(g)(1)������ϵͳ�ﵽƽ��ʱ��O2��NO2�����ʵ����ֱ�Ϊn(O2)=0.1 mol��n(NO2)=3.6 mol�����ʱSO3��������ʵ���Ϊ______________��
(2)������ϵͳ�ﵽƽ��ʱ���������������ƽ����ɣ������ٻ���Ҫ֪�����������ƽ��Ũ�ȣ������������岻��ͬʱ��SO3��______________����NO��______________(�����ǵķ���ʽ)��
(3)�������������������£�����Ϊ��ʼʱ��1 L�����г���2 mol NO2��2 mol SO2������������Ӧ�ﵽƽ��ʱ��cƽ(SO2)=______________mol��L-1��
(1)0.2 mol (2)SO2 NO2 (3)1.9
�������ɹ�ϵʽ��2SO3��O2��2NO��O2����ʣ��O2 0.1 mol,����NO2 3.6 mol����ʣ��SO3Ϊ0.2 mol����Ҫ���������ƽ����ɣ�����֪��һ������������һ�ֵ����������ƽ��Ũ�ȣ���������SO3��SO2��NO2��NO��ƽ��Ũ�ȡ�
����Ϊ1 L�����г���2 mol NO2��2 mol SO2�����൱�ڷ�Ӧ���淴Ӧ��ʼ���뿪ʼʱΪ��Чƽ�⡣

��ϰ��ϵ�д�
 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
�����Ŀ
 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2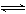 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2