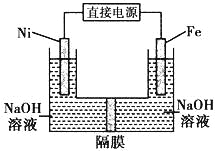
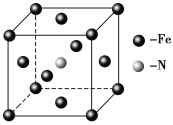
��Ŀ����
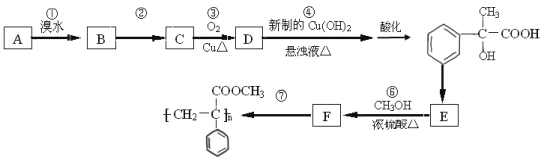
����Ŀ����֪ǰ����������Ԫ��A��B��C��D��E��F�ĺ˵������������Bԭ�ӵ�p�������������⻯��е���ͬ��Ԫ������͵ģ�Dԭ�ӵõ�һ�����Ӻ�3p���ȫ������A��C���γ�AC�����ӻ�������е��������������һ�����Ӳ�.E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��FԪ�غ���������������Ѫ�쵰��Я�������Ĵ�С����ش�
��1��A��B��C��D�ĵ�һ��������С�����˳����__________(��Ԫ�ط������)
��2��������BD3�ķ��ӹ���Ϊ__________��B��ԭ�ӹ���ӻ�����Ϊ__________��BԪ���⻯��ķе������ͬ��������Ԫ�ص��⻯���ԭ����__________��
��3����֪F2+��KCN��Һ��Ӧ��F(CN)2���������������KCN��Һʱ�����ܽ⣬���������.��F�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ__________��CN-��__________(һ�ַ���)��Ϊ�ȵ�����.����CN-�綾�Եķ���֮һ�Ǽ���Ũ��˫��ˮ���ɽ���ת��Ϊ������̼���μ�������д���÷�Ӧ�����ӷ���ʽ��__________��
��4����E��̬ԭ�ӵļ۵����Ų�Ϊ__________����EO2��̼�ᱵ������״̬�·�Ӧ�����þ���ľ����ṹ��ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ__________��
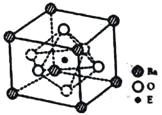
����֪�þ����Ħ������ΪM(g/mol)������E4+������λ��Ϊ__________�����þ����߳�Ϊanm���ɼ���þ�����ܶ�Ϊ__________g/cm3(�����ӵ�����ΪNA)��
���𰸡���1��Na<S<P<C1
��2��������sp3����������
��3��3d64s2��N2��CO��CN-+H2O2+OH-=CO32-+NH3��
��4����3d24s2����TiO2+BaCO3=BaTiO3+CO2������6��M��1021/a3NA
�����������������������Ŀ��������Ϣ�ƶϣ�Bԭ�ӵ�p�������������⻯��е���ͬ��Ԫ������͵ģ���BΪPԪ�أ�Dԭ�ӵõ�һ�����Ӻ�3p���ȫ��������ԭ����������P��ΪClԪ�أ�A��C���γ�A2C�����ӻ�������е��������������һ�����Ӳ㣬�ֱ��ƶϳ�AΪNa��CΪS��E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ����EΪTiԪ�أ�ԭ������֮��Ϊ107����FΪFeԪ�ء�
��1����һ������ͬ���ڴ����ҳ��������ƣ����е���A������A���ʴ�Ϊ��Na��S��P��Cl��
��2��PCl3�ļ۵�����=![]() =4���γ������µ��ӻ�������۵�����=�µ��Ӷ���+��λԭ���������µ��Ӷ���Ϊ1���Թ��ۼ����ų����ã������Ӽ��ܹ��γ��������PH3���Ӽ䲻���γ�������ʴ�Ϊ�������Σ�sp3�ӻ��������γ������
=4���γ������µ��ӻ�������۵�����=�µ��Ӷ���+��λԭ���������µ��Ӷ���Ϊ1���Թ��ۼ����ų����ã������Ӽ��ܹ��γ��������PH3���Ӽ䲻���γ�������ʴ�Ϊ�������Σ�sp3�ӻ��������γ������
��3��FeԪ�ص�ԭ������Ϊ26���۵�����Ϊ8��CN-�ĵȵ�����Ϊ������ԭ�ӣ��Ҽ۵�����Ϊ10�������뵽N2��CN-�ܹ���˫��ˮ����������ԭ��Ӧ����Ӧ�ķ���ʽΪCN-+H2O2+OH-=CO32-+NH3�����ʴ�Ϊ��3d64s2��N2��CN-+H2O2+OH-=CO32-+NH3����
��4����EΪTiԪ�أ���̬ԭ�ӵļ۵����Ų�Ϊ3d24s2���ʴ�Ϊ��3d24s2��
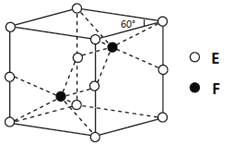
��������Baλ�ڶ��㣬8��![]() =1��Oλ������6��
=1��Oλ������6��![]() =3��Tiλ�����ģ����Ծ��廯ѧʽΪBaTiO3�����ݷ�Ӧ����������֪��ѧ����ʽΪTiO2+BaCO3=BaTiO3+CO2�����ʴ�Ϊ��TiO2+BaCO3=BaTiO3+CO2����
=3��Tiλ�����ģ����Ծ��廯ѧʽΪBaTiO3�����ݷ�Ӧ����������֪��ѧ����ʽΪTiO2+BaCO3=BaTiO3+CO2�����ʴ�Ϊ��TiO2+BaCO3=BaTiO3+CO2����
��Ti4+λ�����ģ�������λ�����ĵ�O�ڽӣ�Ti4+������λ��Ϊ6�������к���һ�������������Ϊ(a��10-7)3��Vm=NA��(a��107)3������=![]() =
=![]() ���ʴ�Ϊ��6��
���ʴ�Ϊ��6��![]() ��
��

 �żӾ���ϵ�д�
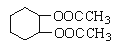
�żӾ���ϵ�д�����Ŀ���ڱ������ᶡ���¹�����һ�ֵ���ɫ����״Һ�壬�ܶ�Լ0.97g/cm3��������������ϩ����֬�����ܼ�����ҵ������ԭ�������������£�
�й����ʵ��������ʼ��±���
������ | �ܽ��� | �۵� | �е� |
�ڱ��������� | ������ˮ�����ѣ��������ȱ����Ҵ������� | 131.6�� | 295�� |
������ | ����ˮ�������Ҵ����ѡ������л��ܼ� | -88.9�� | 117.5�� |
�¹� | ������ˮ�����ڴ����� | 24 | 259�� |
�ڱ������ᶡ���¹��� | ������ˮ�����ڶ����л��ܼ� | ���� | 202��210�� |
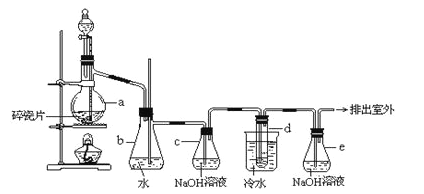
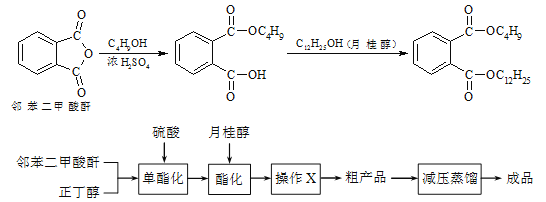
ijʵ��С���ͬѧģ�ҵ�����Ĺ������̣�����ͼ��ʾװ����ȡ�����ڱ������ᶡ���¹�����ͼ�мгֺͼ���װ������ȥ����Ҫ�����������£�
����������ƿ�ڼ���30 g �ڱ�����������16 g �������Լ�����Ũ���ᡣ
�����裬������105 �����������跴Ӧ1Сʱ��
����ȴ�����£�����40 g �¹�������160 �������衢��������Ӧ������
����ȴ�����£�����Ӧ����ﵹ����
��ͨ�����������еIJ���X���õ��ֲ�Ʒ��
��ش��������⣺
��1������C������___________������������ˮӦ��___________����
��2����������жϷ�Ӧ�ѽ����ķ�����___________��
��3��������в���X�ɳ�ȥ����δ��Ӧ���ڱ�����������������������X����___________��
��4�����������м�ѹ�����Ŀ����___________��
��5��ʵ������������ڡ��۲��ʶ��Ƚϸߣ�ԭ����___________��
����Ŀ��ʵ���Ҳ��ü���װ��ģ����ʾ��ҵ����ԭ����ʵ��װ��ͼ��ʵ�鲽�����£�
![]()
![]()
![]()
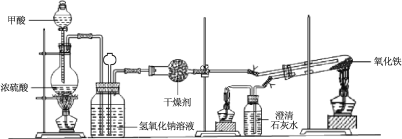
�� ����ͼ���Ӻ�װ�ã����װ�������ԡ�
�� ��ȡ���� Fe2O3��ʯӢ�Թ��У���ȼ�����ƾ��ƣ�����������ᡣ
�� �����ij�������ȼ���������ƾ��ơ�
�� 30 min��Ϩ��ƾ��ƣ��رյ��ɼС�
�� ��������ȴ�����º��ռ����
�� �������Ϸ����ֱ��ռ����������־ƾ��ƣ��������ֿ��Լ��л��桢����¶ȣ��;ƾ���Ƽ��ȵIJ��
��ش��������⣺
��1���Ʊ�CO��ԭ�������ü��ᣨHCOOH����Ũ������������µķֽ��Ƶã�ʢ�ż������������Ϊ ���÷�Ӧ�Ļ�ѧ����ʽ ��
��2��ʵ�鲽����ij�������ָ ��
��3��ʵ�鲽����Ϩ��ƾ��Ƶ�˳��Ϊ______________������I��II��III��
��4��ͨ�������ϻ�ȡ������Ϣ��
I���ƾ���ƽ���¶�Ϊ600���������־ƾ���ƽ���¶�Ϊ700�����ƾ����ƽ���¶�Ϊ930����
II������ָ������Ӧ�¶ȸ���710����Fe���ȶ����ڣ�680����710��֮�䣬FeO�ȶ����ڣ�����680��������Ҫ��Fe3O4���Է����ƾ��Ƽ�������������Fe��ԭ���� ��
��5����֪FeO��Fe2O3��Fe3O4��Ԫ�ص����������ֱ�Ϊ��22.2%��30%��27.6%�����������������3����Ʒ����Ԫ�������Ԫ�ص������������±���
���ȷ�ʽ | ����Ԫ����� | ��Ԫ�ص���������%[��������] | |
Fe | O | ||
�ƾ��� | Fe��O | 74.50 | 25.50 |
�����־ƾ��� | Fe��O | 76.48 | 23.52 |
�ƾ���� | Fe | 100.00 | 0.00 |
������Ԫ�ص�����������֪ǰ���ּ��ȷ�ʽ�õ��IJ���Ϊ�������оƾ��Ƽ������ò������������_______�ֿ��ܡ�
��6��ͨ����һ���������������ǰ���ּ��ȷ�ʽ�õ��Ĺ����ĩ�ɷ־�ΪFe3O4��Fe���þƾ���Ƽ��ȵõ��Ĺ����ĩ�ɷ�ΪFe����������þƾ��Ƽ��ȷ�ʽ�������Fe3O4��Fe��������Ϊ_____����Ҫ����������