题目内容
某澄清透明溶液中只可能含有:①A13+;②Mg2+;③Fe3+;④Cu2+;⑤H+;⑥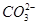 ;⑦
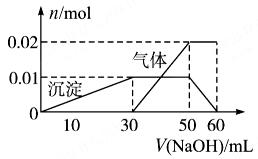
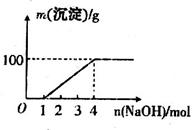
;⑦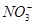 中的几种离子,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量如图所示。则该溶液中一定含有的离子是
中的几种离子,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量如图所示。则该溶液中一定含有的离子是
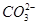 ;⑦
;⑦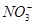 中的几种离子,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量如图所示。则该溶液中一定含有的离子是
中的几种离子,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量如图所示。则该溶液中一定含有的离子是
| A.②⑤⑦ | B.②⑤⑥ | C.③⑤⑦ | D.①④⑤ |
A
试题分析:0-1mol无沉淀生成,说明有H+,则无
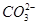 ,有
,有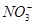 。1mol至过量,生成沉淀,且沉淀量不下降,则无A13+。故选A项。
。1mol至过量,生成沉淀,且沉淀量不下降,则无A13+。故选A项。
练习册系列答案
相关题目