题目内容
【题目】2016年冬季全国大部分地区出现雾霾现象,汽车尾气是造成雾霾的原因之一,汽车尾气含CO、NO等有毒气体。为了减少CO 对大气的污染,某研究性学习小组拟研究CO和H2O 反应转化为绿色能源H2。己如:
2CO(g)+O2(g)=2CO2(g); △H= -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·moL-1
H2O(g)=H2O(l) △H= -44.0kJ·moL-1
(1)氢气燃烧热△H=_____________________。
(2)写出CO 和H2O(g)作用生成CO2 和H2的热化学方程式______________________。
(3)往1L 体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为____________;反应达到平衡后,升高温度,此时平衡常数将____________(填“变大”、“ 不变”或“变 小”)。
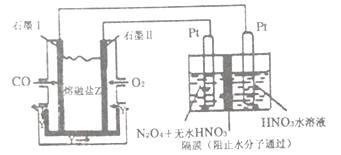
(4)从汽车尾气中分离出CO 与O2、与熔融盐Na2CO3组成燃料电池,同时采用电解法制备N2O5,装置如下图所示,其中Y为CO2。写出石墨Ⅰ电极上发生反应的电极反应式________________。在电解池中生成N2O5的电极反应式为______________________。
(5)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
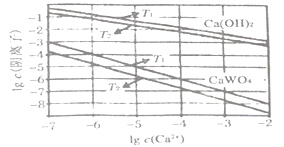
T1___________T2 (填“>”或“<”),T1时Ksp (CaWO4)=________。
【答案】-285.8 kJ·moL-1 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2KJ·moL-1 83.3% 减小 CO+CO32--2e- = 2CO2 N2O4 +2HNO3-2e- = 2N2O5+2H+ < 1×10-10(mol/L)2
【解析】
试题(1)氢气的燃烧热是1mol氢气完全燃烧生成液态水放出的热量,根据盖斯定律计算氢气燃烧热;(2)根据盖斯定律计算CO和H2O(g)作用生成CO2和H2的焓变;(3)利用“三段式”计算CO的转化率;CO和H2O(g)作用生成CO2和H2正反应放热,升高温度平衡逆向移动;(4)CO与O2、熔融盐Na2CO3组成燃料电池,CO发生氧化反应,通入CO的一极是负极;电解池中N2O4失电子发生氧化反应生成N2O5;(5)溶解度均随温度升高而减小,温度越低离子浓度越大;T1时Ksp(CaWO4)=![]() ;
;
解析:(1)①2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·moL-1
②H2O(g)=H2O(l) △H=-44.0kJ·moL-1 ;根据盖斯定律①+②×2得2H2(g)+O2(g)=2H2O(l); △H=-571.6kJ·moL-1,氢气的燃烧热是1mol氢气完全燃烧生成液态水放出的热量,所以氢气燃烧热△H= -285.8 kJ·moL-1;
(2)①2CO(g)+O2(g)=2CO2(g); △H=-566kJ·moL-1
②2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·moL-1
根据盖斯定律①![]() -②
-②![]() 得CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= - 41.2KJ·moL-1;
得CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= - 41.2KJ·moL-1;
(3)
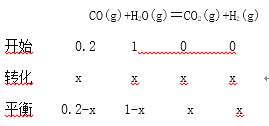
![]()
X=![]() ;则t℃时CO的转化率为
;则t℃时CO的转化率为![]()
![]() 83.3%;CO和H2O(g)作用生成CO2和H2正反应放热,升高温度平衡逆向移动,平衡常数减小;(4)CO与O2、熔融盐Na2CO3组成燃料电池,通入CO的一极是负极,CO失电子发生氧化反应生成二氧化碳,电极反应为CO+CO32--2e- = 2CO2;电解池中N2O4失电子发生氧化反应生成N2O5,电解池中生成N2O5的电极反应式为N2O4 +2HNO3-2e- = 2N2O5+2H+;(5)溶解度均随温度升高而减小,温度越低离子浓度越大,所以T1<T2;T1时Ksp(CaWO4)=
83.3%;CO和H2O(g)作用生成CO2和H2正反应放热,升高温度平衡逆向移动,平衡常数减小;(4)CO与O2、熔融盐Na2CO3组成燃料电池,通入CO的一极是负极,CO失电子发生氧化反应生成二氧化碳,电极反应为CO+CO32--2e- = 2CO2;电解池中N2O4失电子发生氧化反应生成N2O5,电解池中生成N2O5的电极反应式为N2O4 +2HNO3-2e- = 2N2O5+2H+;(5)溶解度均随温度升高而减小,温度越低离子浓度越大,所以T1<T2;T1时Ksp(CaWO4)=![]() =
=![]() (mol/L)2 ;
(mol/L)2 ;

 名校课堂系列答案
名校课堂系列答案