题目内容
4.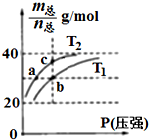 已知(HF)2(g)?2HF(g),△H>0,且平衡体系的总质量[m(总)]与总物质的量[n(总)]之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( )
已知(HF)2(g)?2HF(g),△H>0,且平衡体系的总质量[m(总)]与总物质的量[n(总)]之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( )| A. | 温度:T1<T2 | |
| B. | 平衡常数:K(a)=K(b)<K(c) | |
| C. | 反应速率:Vb>Va | |
| D. | 当$\frac{m(总)}{n(总)}$=30g/mol时,n(HF):n(HF)2=2:1 |
分析 A、根据平衡体系的总质量[m(总)]与总物质的量[n总]之比为混合气体平均摩尔质量,反应是吸热反应,升温平衡正向进行,气体物质的量增大,总质量[m(总)]与总物质的量[n总]之比减小分析;
B、平衡常数随温度变化,不随压强变化;
C、依据温度对化学反应速率的影响判断;
D、根据$\frac{总质量}{总物质的量}$的值,可计算出混合体系中n(HF)与n(HF)2的比值并判断.
解答 解:A、根据平衡体系的总质量[m(总)]与总物质的量[n总]之比为混合气体平均摩尔质量,反应是吸热反应,升温平衡正向进行,气体物质的量增大,总质量[m(总)]与总物质的量[n总]之比减小分析,T1>T2,故A错误;
B、平衡常数随温度变化,不随压强变化,温度越高,平衡正向进行,平衡常数增大,平衡常数:K(a)=K(c)<K(b),故B错误;
C、分析判断可知T1>T2,温度越高反应速率越快,反应速率:Vb>Va,故C正确;
D、设n(HF):n[(HF)2]=x:y,根据$\frac{m{\;}_{(总)}}{n{\;}_{(总)}}$=$\frac{20x+40y}{x+y}$=30g/mol,得x:y=1:1,故D错误;
故选C.
点评 本题考查了化学平衡的建立过程分析,平衡影响因素的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
14.常温常压下,下列各组气体能共存的是( )
| A. | SO2和O2 | B. | NO和O2 | C. | H2S和SO2 | D. | NH3和HCl |
12.同系物具有( )
①相同的通式 ②相同的物理性质 ③相似的化学性质 ④相似的结构特征 ⑤不同的分子式.
①相同的通式 ②相同的物理性质 ③相似的化学性质 ④相似的结构特征 ⑤不同的分子式.
| A. | ①②③④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②④⑤ |
19.月球的矿产资源极为丰富,仅月球表层5cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石[MgFeSiO4]等,下列说法或分析不正确的是( )
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 斜长石的氧化物形式可表示为:K2O•Al2O3•6SiO2 | |
| C. | 橄榄石中铁为+2价 | |
| D. | 月球上有游离态铁是因为月球上铁的活性比地球上铁的活动性弱 |
9.硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示:

已知某些氢氧化物沉淀的pH如下表所示:
(1)MgO的电子式为 .
.
(2)滤渣2的主要成分是Fe(OH)3、Al(OH)3,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为Mg2++2OH-═Mg(OH)2↓.
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为2Mg(OH)2+2SO2+O2═2MgSO4+2H2O.
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为$\frac{20b}{29a}$(用含有a、b的代数式表示).

已知某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 Al(OH)3 | 2.7 3.7 | 3.7 4.7 |
 .
.(2)滤渣2的主要成分是Fe(OH)3、Al(OH)3,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为Mg2++2OH-═Mg(OH)2↓.
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为2Mg(OH)2+2SO2+O2═2MgSO4+2H2O.
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为$\frac{20b}{29a}$(用含有a、b的代数式表示).
 炔烃
炔烃 醚
醚 酯
酯 酯
酯 醇
醇 酚
酚 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )  合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验. 碳氧化物的转化有重大用途,回答关于CO和CO2的问题.
碳氧化物的转化有重大用途,回答关于CO和CO2的问题.