题目内容
【题目】甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答问题:
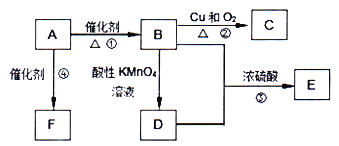
(1)它们制取氨气的化学方程式为:______________________________________。
(2)三位同学都用向下排空气法收集氨气,其原因是_____________________。

(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(实验操作都正确),你认为没有收集到氨气的同学是________填(“甲”、“乙”或“丙”)。
(4)三位同学都认为他们的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的的是________填(“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替?________(填“能”或“不能”)。
【答案】 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O NH3的密度小于空气的 乙 丙 不能
CaCl2+2NH3↑+2H2O NH3的密度小于空气的 乙 丙 不能
【解析】分析:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,据此书写方程式;
(2)根据氨气的溶解性和密度选择收集氨气的方法;
(3)根据氨气能与硫酸反应而被硫酸吸收分析;
(4)根据碳酸氢铵、氯化铵加热分解的生成物性质分析解答。
详解:(1)实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,不能用排水法收集,氨气密度比空气小,应该用向下排空法收集;
(3)氨气为碱性气体,通过盛有浓硫酸的洗气瓶时,与硫酸反应而被吸收,所以乙同学不能得到氨气;
(4)碳酸氢铵加热分解生成氨气、二氧化碳和水,其中可用碱石灰吸收二氧化碳和水,只有丙能做到;氯化铵加热分解生成氨气和氯化氢,在温度较低时又重新化合反应生成氯化铵,因此只用氯化铵无法获得氨气。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案