题目内容
14.由下列所给信息(Ⅰ、Ⅱ),结合所学知识,回答下列问题:Ⅰ.
 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环戊烯的化学性质跟链烯烃相似.
,环戊烯的化学性质跟链烯烃相似.Ⅱ.有机化合物分子中的碳碳双键可以跟臭氧反应,再在锌粉存在下水解,这两步反应合称“烯烃的臭氧化分解”.例如:

(1)写出异戊二烯(
 )臭氧化分解各种产物的结构简式及其物质的量之比n(HCHO):n(CH3COCHO)=2:1.
)臭氧化分解各种产物的结构简式及其物质的量之比n(HCHO):n(CH3COCHO)=2:1.(2)某烃A,分子式为C10H16.A经臭氧化分解可得到等物质的量的两种产物,其结构简式分别为HCHO和
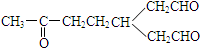 ,A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.则A的键线式为
,A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.则A的键线式为 .
.
分析 (1)根据题意,断裂位置为C=C,可生成HCHO、CH3COCHO;
(2)A经催化加氢得产物B,B的分子式是C10H20,且B内含有六元碳环,说明A中含有2个C=C,结合产物可知A、B的结构简式.
解答 解:(1)由题意可知,断裂位置为C=C,可生成HCHO、CH3COCHO,n(HCHO):n(CH3COCHO)=2:1,
故答案为:n(HCHO):n(CH3COCHO)=2:1;
(2)A经催化加氢得产物B,B的分子式是C10H20,且B内含有六元碳环,说明A中含有2个C=C,则A为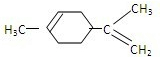 ,B为
,B为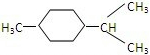 ,
,
故答案为: .
.
点评 本题考查有机物的推断,题目难度中等,解答本题的关键是把我题给信息,答题时注意体会.

练习册系列答案
相关题目
4.“结晶玫瑰”具有强烈的玫瑰香气,是一种很好的定香剂.其化学名称为“乙酸三氯甲基苯甲酯”,通常用三氯甲基苯基甲醇和醋酸酐为原料制备:

已知:
加料加热3小时,控制温度在110℃粗产品反应液倒入冰水中抽滤
操作步骤和装置如下:$\stackrel{加料}{→}$ $→_{温度在110℃}^{加热3小时,控制}$ $→_{入冰水中}^{反应液倒}$ $\stackrel{抽滤}{→}$粗产品
请根据以上信息,回答下列问题:
(1)加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并搅拌.待混合均匀后,最适宜的加热方式为油浴加热(填“水浴加热”或“油浴加热”).
(2)粗产品的成分是结晶玫瑰与少量三氯甲基苯基甲醇的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
(3)某同学欲在重结晶时获得较大的晶体,查阅资料得到如下信息:
不稳定区出现大量微小晶核,产生较多颗粒的小晶体;
亚稳过饱和区,加入晶种,晶体生长;
稳定区晶体不可能生长
由信息可知,从高温浓溶液中获得较大晶体的操作为加入晶种,缓慢降温.
(4)22.45g三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰22.74g,则产率是85%.(保留两位有效数字)


已知:
| 三氯甲基苯基甲醇 | 式量:224.5.无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 式量:267.5.白色至微黄色晶体.熔点:88℃.不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g. |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
操作步骤和装置如下:$\stackrel{加料}{→}$ $→_{温度在110℃}^{加热3小时,控制}$ $→_{入冰水中}^{反应液倒}$ $\stackrel{抽滤}{→}$粗产品
请根据以上信息,回答下列问题:
(1)加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并搅拌.待混合均匀后,最适宜的加热方式为油浴加热(填“水浴加热”或“油浴加热”).
(2)粗产品的成分是结晶玫瑰与少量三氯甲基苯基甲醇的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在乙醇中,按粗产品、溶剂的质量比为1:$\frac{a}{100}$混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | 70℃时结晶玫瑰在乙醇中溶解 |
| ② | 将步骤1所得溶液冷却结晶 抽滤 | 得到白色晶体 | 在常温下结晶玫瑰在乙醇中溶解度较小 |
| ③ | 干燥步骤2所得白色晶体,加热使其融化,测其熔点 | 白色晶体在88℃左右完全熔化 | 白色晶体是结晶玫瑰 |
不稳定区出现大量微小晶核,产生较多颗粒的小晶体;
亚稳过饱和区,加入晶种,晶体生长;
稳定区晶体不可能生长
由信息可知,从高温浓溶液中获得较大晶体的操作为加入晶种,缓慢降温.
(4)22.45g三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰22.74g,则产率是85%.(保留两位有效数字)

5.下列各种冶炼方法中,可制得相应金属的是( )
| A. | 加热Al2O3 | B. | 加热CaCO3 | ||
| C. | 电解熔融NaCl | D. | 氰化钠与铝粉高温共热 |
2.下列说法中正确的是( )
| A. | 因为p轨道是“8”字形的,所以p的电子走“8”字形 | |
| B. | K能级有3s,3p,3d,3f四个轨道 | |
| C. | 氢原子只有一个电子,故氢原子只有一个轨道 | |
| D. | 以上说法均不正确 |
9.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mo1•L-1 | |
| B. | 标准状况下,22.4L水所含的分子数为NA | |
| C. | 常温常压下NO2和N2O4混合气体22.4L,其中含有的原子总数为0.3NA | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |
19.第3周期某元素的原子,其最外层3p亚层上有一个未成对电子,则关于该元素的描述正确的是( )
| A. | 该元素最高价氧化物的水化物肯定是一种强酸 | |
| B. | 该元素单质肯定是一种黄绿色的气体 | |
| C. | 该元素的最高价氧化物水化物肯定能与强碱反应 | |
| D. | 该元素的原子半径在同周期中肯定是最小的(稀有气体元素除外) |
6.2NO2(g)?N2O4(g)达到平衡后下列条件的改变可使NO2气体浓度增大的是( )
| A. | 增大容器的容积 | B. | 再充入一定量的N2O4 | ||
| C. | 分离出一定量的NO2 | D. | 再充入一定量的He |
4.下列中和反应中放出热量最多的是( )
| A. | 100 mL 0.3 mol/L的HCl和50 mL 0.3 mol/L的NaOH相混合 | |
| B. | 80mL 0.3 mol/L的HCl和80 mL 0.3 mol/L的NaOH溶液相混合 | |
| C. | 80mL 0.3 mol/L的H2SO4和80 mL 0.3 mol/L的NaOH溶液相混合 | |
| D. | 50mL 0.3 mol/L的H2SO4和50 mL 0.6 mol/L的NaOH溶液相混合 |
 ;该微粒还可与Cu2+形成[Cu(H2O)4]+(填化学式)而使CuCl2溶液呈蓝色;
;该微粒还可与Cu2+形成[Cu(H2O)4]+(填化学式)而使CuCl2溶液呈蓝色;