题目内容
(12分)已知在K2CrO4的溶液中存在着如下的平衡:
(1)浅黄色难溶化合物BaCrO4和过量的硫酸作用后,能产生白色沉淀,则有关的离子方程式为:
(2)向K2Cr2O7溶液中加入Pb(NO3)2并充分搅拌后,溶液的pH明显降低,其原因是:
(3)用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中Cr2O72-的浓度小于10-5mol/L。则配制时除K2Cr2O7、H2O外还用到的试剂是:KOH ,溶液的pH应:( ) 8.5 (填大于、等于或小于多少)。
(4)在碱性(c OH- = 1 mol/L)介质中铬和过氧化氢分别有如下的元素电势图:
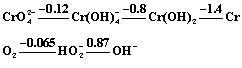
把H2O2写成HO2-的原因是: ; 向KCr(SO4)溶液中,加过量的NaOH和过量的H2O2,则HO2-参与反应的离子方程式为:
(1)2 BaCrO4 + 2 H+ + 2 SO42- = 2 BaSO4¯ + Cr2O72-+ H2O
(2)Cr2O72- 和Pb2+、H2O反应,生成难溶物PbCrO4,同时放出H+
(3)大于
(4)H2O2显弱酸性,在强碱介质中以HO2-为主要存在型体;
向KCr(SO4)溶液中,加过量的NaOH和过量的H2O2,则HO2-参与反应的离子方程式为:
2 Cr(OH) 4- + 3 HO2- = 2 CrO42- + 5 H2O + OH-
或 2 Cr3+ + 3 HO2- + 7 OH- = 2 CrO42- + 5 H2O
2 HO2- = O2 + 2OH-

(Ⅰ)(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= mol/L。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3) 常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_________。(填“>7”、“<7”、或“无法确定”)
(Ⅱ)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的 。
A. KBr B. KI C. K2S D. K2CrO4