题目内容
下列反应在210℃时达到平衡:
①PCl5(g)?PCl3(g)+Cl2(g);△H1>0 K1=1mol?L-1
②CO(g)+Cl2(g)?COCl2(g);△H1<0 K2=5×104L?mol-1
③COCl2(g)?CO(g)+Cl2(g)
④2SO2(g)+O2(g)?2SO3(g);△H4<0
(1)反应③的平衡常数K3为 .
(2)要使反应①和反应②的K数值相等,可采取的措施是 (填序号).
A.降低反应①、②体系中Cl2浓度B.反应①、②选择不同的催化剂
C.反应①、反应②同时升高温度D.反应①、反应②同时降低温度
E.反应①降低温度,反应②维持210℃
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定.起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡.下列有关它们达到平衡状态后的叙述正确的是 (填序号).
A.体积:甲可能小于乙
B.SO3的物质的量:甲一定小于乙
C.压强:甲可能大于乙
D.浓度比c(SO2)/c(SO3):甲一定小于乙
(4)丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为12mol.现向容器中加xmolSO2,6.5mol O2,2.0molSO3.
①若x=5.5,需要 (填“降低”“升高”或“保持”)体系温度,使反应在平衡时达到题设要求;
②欲使起始反应维持向逆反应方向移动,则x的取值范围为 .
①PCl5(g)?PCl3(g)+Cl2(g);△H1>0 K1=1mol?L-1
②CO(g)+Cl2(g)?COCl2(g);△H1<0 K2=5×104L?mol-1
③COCl2(g)?CO(g)+Cl2(g)
④2SO2(g)+O2(g)?2SO3(g);△H4<0
(1)反应③的平衡常数K3为
(2)要使反应①和反应②的K数值相等,可采取的措施是
A.降低反应①、②体系中Cl2浓度B.反应①、②选择不同的催化剂
C.反应①、反应②同时升高温度D.反应①、反应②同时降低温度
E.反应①降低温度,反应②维持210℃
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定.起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡.下列有关它们达到平衡状态后的叙述正确的是
A.体积:甲可能小于乙
B.SO3的物质的量:甲一定小于乙
C.压强:甲可能大于乙
D.浓度比c(SO2)/c(SO3):甲一定小于乙
(4)丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为12mol.现向容器中加xmolSO2,6.5mol O2,2.0molSO3.
①若x=5.5,需要
②欲使起始反应维持向逆反应方向移动,则x的取值范围为
分析:(1)反应③是反应②的逆反应,平衡常数成倒数关系;
(2)平衡常数只受温度影响,要使反应①和反应②的K数值相等,由平衡常数数值可知,则应使K1增大、K2减小,结合温度对平衡的影响判断;
(3)依据恒温容器、恒压容器的特征分析判断;
(4)①依据气体总物质的量不变,比较加入量判断反应进行的方向;
②欲使起始反应维持向逆反应方向移动,即先气体物质的量增大的方向进行.
(2)平衡常数只受温度影响,要使反应①和反应②的K数值相等,由平衡常数数值可知,则应使K1增大、K2减小,结合温度对平衡的影响判断;
(3)依据恒温容器、恒压容器的特征分析判断;
(4)①依据气体总物质的量不变,比较加入量判断反应进行的方向;
②欲使起始反应维持向逆反应方向移动,即先气体物质的量增大的方向进行.
解答:解:(1)平衡常数等于生成物浓度的化学计量数幂之积除以反应物的浓度的化学计量数幂之积,②CO(g)+Cl2(g)?COCl2(g);△H1<0 K2=5×104L?mol-1,③COCl2(g)?CO(g)+Cl2(g)逆反应,平衡常数K3=
=
=2×10-5 mol?L-1,
故答案为:2×10-5 mol?L-1;
(2)要使反应①和反应②的K数值相等,则应使K1增大、K2减小,反应①正反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大;反应②正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,故应适当升高温度,
故选C.
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定.起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡;
A.反应是气体体积减小的反应,甲恒容、乙恒压体积减小,所以体积甲不可能小于乙,故A错误;
B.反应是气体体积减小的反应,甲恒容、乙恒压体积减小压强增大,比甲平衡后进行程度大,平衡时乙中SO3的物质的量大:甲一定小于乙,故B正确;
C.反应是气体体积减小的反应,甲恒容压强减小、乙恒压压强不变:甲不可能大于乙,故C错误;
D.反应是气体体积减小的反应,甲恒容、乙恒压体积减小压强增大,比甲平衡后进行程度大,平衡时乙中SO3的物质的量大,浓度比c(SO2)/c(SO3):甲一定大于乙,故D错误;
故答案为:B;
(4)①丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为12mol.现向容器中加xmolSO2,6.5mol O2,2.0molSO3.
①若x=5.5,则5.5+6.5+2.0=14>12,需要向气体物质的量减小的方向进行,即向正反应方向进行,反应是放热反应,需要降低温度,故答案为:降低;
②保持容器内气体总物质的量为12mol时,x+6.5+2.0=12,x=3.5,欲使起始反应维持向逆反应方向移动,向气体物质的量增大的方向进行,逆向进行彻底时,x取最小值,2+x+6.5+1=12,x=2.5,则x的取值范围为2.5<χ<3.5,
故答案为:2.5<χ<3.5.
| 1 |
| K2 |
| 1 |
| 5×104 |
故答案为:2×10-5 mol?L-1;
(2)要使反应①和反应②的K数值相等,则应使K1增大、K2减小,反应①正反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大;反应②正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,故应适当升高温度,
故选C.
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定.起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡;
A.反应是气体体积减小的反应,甲恒容、乙恒压体积减小,所以体积甲不可能小于乙,故A错误;
B.反应是气体体积减小的反应,甲恒容、乙恒压体积减小压强增大,比甲平衡后进行程度大,平衡时乙中SO3的物质的量大:甲一定小于乙,故B正确;
C.反应是气体体积减小的反应,甲恒容压强减小、乙恒压压强不变:甲不可能大于乙,故C错误;
D.反应是气体体积减小的反应,甲恒容、乙恒压体积减小压强增大,比甲平衡后进行程度大,平衡时乙中SO3的物质的量大,浓度比c(SO2)/c(SO3):甲一定大于乙,故D错误;
故答案为:B;
(4)①丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为12mol.现向容器中加xmolSO2,6.5mol O2,2.0molSO3.
①若x=5.5,则5.5+6.5+2.0=14>12,需要向气体物质的量减小的方向进行,即向正反应方向进行,反应是放热反应,需要降低温度,故答案为:降低;
②保持容器内气体总物质的量为12mol时,x+6.5+2.0=12,x=3.5,欲使起始反应维持向逆反应方向移动,向气体物质的量增大的方向进行,逆向进行彻底时,x取最小值,2+x+6.5+1=12,x=2.5,则x的取值范围为2.5<χ<3.5,
故答案为:2.5<χ<3.5.
点评:本题考查了化学平衡的影响因素分析判断,平衡移动方向的判断,掌握平衡移动原理是解题关键,题目难度中等.

练习册系列答案
相关题目
 到平衡:
到平衡: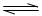 PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1
PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1 。
。 PCl3(g)+Cl2(g);△H1>0
K1=1mol·L—1
PCl3(g)+Cl2(g);△H1>0
K1=1mol·L—1