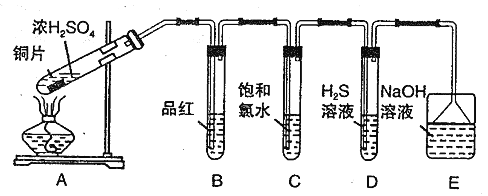
��Ŀ����
����Ŀ����֪���ڵ��볣��ΪKa��ijһԪ����ζ������У�pHͻ������Ũ�ȵ������������Ũ����ҪӰ��ζ��յ�͵ζ��յ�֮������߲��֡������£��ò�ͬŨ�ȵ�NaOH��Һ�ֱ�ζ�20mL����ͬŨ�ȵ�ij����HA��Һ���ζ�������ͼ��ʾ������˵������ȷ����

A. ��ͼ��֪��c1>c2>c3
B. M����Һ�д���:c(H+)+c(HA)=c(OH-)+c(A-)
C. ǡ���к�ʱ����Һ������Ũ�ȵĴ�С��ϵ: c(Na+)>c(A-��>c(OH-)>c(H+)
D. ��pH=7��Һ�����: ![]()
���𰸡�B
��������A. �ò�ͬŨ�ȵ�NaOH��Һ�ֱ�ζ�20mL����ͬŨ�ȵ�ij����HA��Һ���ζ��յ�֮������ͬ���������������Һ����������Ũ��Խ��������������Խ�࣬��Һ�ļ���Խǿ��pHԽ�����c1>c2>c3����A��ȷ��B. M����Һ�д��ڵ���غ�������غ㣬��c(H+)+ c(Na+)= c(A-)+c(OH-)��c(Na+)= c(A-)+ c(HA)�����c(H+)+c(HA)=c(OH-)����B����C. ǡ���к�ʱ����Һ�е�����ΪNaA��A-ˮ�⣬��Һ�Լ��ԣ���Һ������Ũ�ȵĴ�С��ϵ:c(Na+)>c(A->c(OH-)>c(H+)����C��ȷ��D. ��NaOH��ҺHA��Һ��Ũ�Ⱦ�Ϊc mol/L��pH=7ʱ�����������������ҺΪVmL�����ɵ�NaAΪV��10-3cmol����Һ�д���c(H+)=c(OH-)��Ka=![]() =
=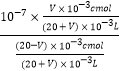 =
=![]() ����D��ȷ����ѡB��
����D��ȷ����ѡB��

 ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д� �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�����Ŀ����������Ԫ�أ�����B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش�����
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��ǣ�I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
Dԭ�Ӻ�������p���ȫ������� |
EԪ�ص����������������������4 |
F ��ǰ������ԭ�ӵ����Ų�ͼ�е�����������Ԫ�� |
G�����ڱ��ĵ�ʮһ�� |
��1��B��̬ԭ�ӵĵ����Ų�ʽΪ��F��̬ԭ�ӵļ۵����Ų�ʽΪ��G��̬ԭ�ӵ����������Ų�ͼΪ ��
��2��C��������������Ԫ��ԭ�ӵĵ�һ�������ɴ�С��˳��������Ԫ�ط�����գ���
��3��B��D�ĵ縺����Դ�С��BD���á����ڡ�����С�ڡ����ڡ���գ���
��4����������Ԫ���У�λ��s�������֣�λ��p�������֣�
��5��DE3�ĵ���ʽΪ ��