题目内容
11.化学键的键能是指气态原子间形成1mol化学键时释放的能量.如H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297KJ•mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量.一个化学反应一般都有旧化学键的破坏和新化学键的形成.下表是一些键能数据(KJ•mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | H-F | 565 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | C-F | 427 |
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
(2)已知反应H2(g)+Cl2(g)=2HCl(g)生成2mol氯化氢放热185KJ,并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是化学反应的反应热等于反应物的键能之和与生成物的键能之和的差=185(KJ).
分析 (1)比较半径与键能大小要在同一标准下进行,否则没有可比性,同主族元素的半径越大,键能越小;
(2)化学反应的反应热等于反应物的键能之和与生成物的键能之和的差.
解答 解:(1)由表中数据可知,原子半径F>H,但键能:H-F>H-H,则不能得出半径越小的原子形成的共价键越牢固的结论,Cl的非金属性大于H,但键能H-H>Cl-Cl,也不能说明非金属性越强的原子形成的共价键越牢固,由H-F、H-Cl、H-Br、H-I的键能可以看出,与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;Br的原子半径介于Cl与I之间,C-Br的键能介于C-Cl与C-I之间,即218KJ•mol-1~330 KJ•mol-1之间,
故答案为:①不能;②不能;与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;218KJ•mol-1,330 KJ•mol-1;
(2)已知:热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ•mol-1,
可得出△H=436kJ/mol+243kJ/mol-2×432kJ/mol=-185kJ/mol,则有化学反应的反应热等于反应物的键能之和与生成物的键能之和的差,
故答案为:化学反应的反应热等于反应物的键能之和与生成物的键能之和的差;
点评 本题考查新信息数据处理能力,断裂化学键难易与形成化学键的两个原子的性质有关,比较时要选择同一标准,否则不可比,依题意,C-Br键能介于C-I、C-Cl键能之间.根据反应的数据得出根据键能计算反应的规律,再运用这一规律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1. X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )| A. | 最高价氧化物对应水化物的酸性最强的是W | |
| B. | Y与Z只能形成一种化合物 | |
| C. | 简单阴离子还原性:Y>W | |
| D. | Z与Q形成的化合物可能含共价键 |
2.利用图1所示实验(部分装置)收集氯气并验证氯气的性质:
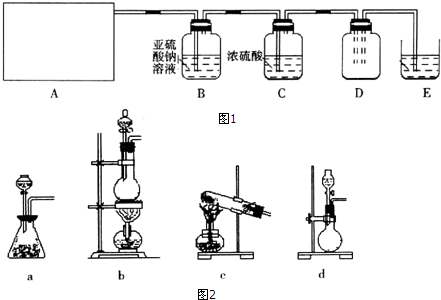
(1)A为Cl2的发生装置.若制取氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,与之对应的A装置(图2)是b(填写装置的序号).
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改).
(3)写出装置E中反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,在酒精烧至红热,然后伸入盛有氯气的集气瓶中.
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+.试设计实验方案,检验洗气瓶B溶液中Cl和SO42-的存在.可供选择的试剂及仪器为:
稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管.

(1)A为Cl2的发生装置.若制取氯气的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,与之对应的A装置(图2)是b(填写装置的序号).
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改).
(3)写出装置E中反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,在酒精烧至红热,然后伸入盛有氯气的集气瓶中.
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+.试设计实验方案,检验洗气瓶B溶液中Cl和SO42-的存在.可供选择的试剂及仪器为:
稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量B中溶液于试管Ⅰ中,滴加过量稀盐酸和BaCl2溶液 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42- |
| 步骤2:另取适量B中溶液于试管Ⅱ中,滴加过量Ba(NO3)2溶液,振荡,静置 | 产生白色沉淀 |
| 步骤3:取步骤2后试管Ⅱ中的上层清液于试管Ⅲ中,滴加稀HNO3和AgNO3溶液. | 若产生白色沉淀,则洗气瓶白溶液中存在Cl- |
19.某单烯烃与氢气加成以后的产物是(CH3)2CHCH(CH3)C(CH3)3,该烯烃可能结构有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
6.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种过渡元素硼氢化物储氢材料.
①基态Ti3+中含有的电子数为19,电子占据的最高能级是3d,该能级具有的原子轨道数为5;
②BH-4中B的杂化方式是sp3杂化.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”);
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如表所示
该氢化物的化学式为MgH2.
(1)Ti(BH4)3是一种过渡元素硼氢化物储氢材料.
①基态Ti3+中含有的电子数为19,电子占据的最高能级是3d,该能级具有的原子轨道数为5;
②BH-4中B的杂化方式是sp3杂化.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”);
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如表所示
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
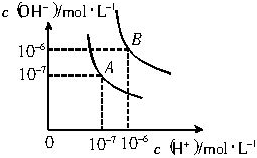 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.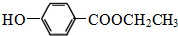
 .
.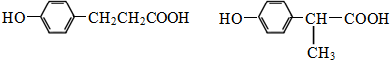 .
.