题目内容
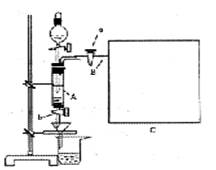
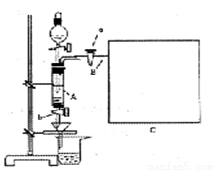
三氯化铁是中学化学实验室中不可缺少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如下图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a、关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并除去多余的HNO3,再降温结晶得FeCl3·6H2O晶体,填写下列空白:
(1)滴加盐酸时,发现反应速率比盐酸与纯铁粉的反应快,其原因是_________________。
(2)烧杯中稀HNO3的作用是(用离子方程式表示)_______________________________。
(3)整个实验过程中,弹簧夹a必须始终打开,其目的是___________________________。
(4)若不用降温结晶的方法制取FeCl3·6H2O,而是直接将溶液蒸干,则此时得到的固体是____________(写化学式)。
(5)把制得的FeCl3·6H2O适量放入水中配成浓溶液,取少量滴入沸水中,可以得到一种红褐色的透明的分散系。写出有关的化学方程式:____________________________________。
(1)因为废铁屑中含有铜,形成了Cu—Fe原电池,加快了反应速率
(2)3Fe2++![]() +4H+====3Fe3++NO↑+2H2O
+4H+====3Fe3++NO↑+2H2O
(3)导出气体,使分液漏斗中液体能顺利流下
(4)Fe2O3
(5)FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
解析:(1)废铁屑含有Cu,形成了原电池,所以反应速率快。(2)Fe与HCl反应只得FeCl2,欲得FeCl3·6H2O尚需将Fe2+氧化为Fe3+,由此考虑,可知HNO3用于氧化Fe2+为Fe3+,3Fe2++![]() +4H+====3Fe3++NO↑+2H2O。(3)设想打开a和不打开a的情境并对比,可知a始终打开的目的是导出气体,并使分液漏斗内的盐酸能顺利流下。(4)直接将溶液蒸干时,FeCl3+3H2O
+4H+====3Fe3++NO↑+2H2O。(3)设想打开a和不打开a的情境并对比,可知a始终打开的目的是导出气体,并使分液漏斗内的盐酸能顺利流下。(4)直接将溶液蒸干时,FeCl3+3H2O![]() Fe(OH)3↓+3HCl↑,2Fe(OH)3
Fe(OH)3↓+3HCl↑,2Fe(OH)3![]() Fe2O3+3H2O,最终得到的固体为Fe2O3。(5)所得溶液为Fe(OH)3胶体,FeCl3+3H2O
Fe2O3+3H2O,最终得到的固体为Fe2O3。(5)所得溶液为Fe(OH)3胶体,FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。