题目内容
【题目】在Cl-的物质的量浓度为0.5molL-1的某无色澄清溶液中,还可能含有如表中所示的若干种离子.
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3 |
阴离子 | NO3- CO32- SiO32- SO42- OH- |
现取该溶液200mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)通过以上实验不能确定是否存在的离子是
(2)实验Ⅰ中生成气体的离子方程式为
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
阴离子 | 浓度c/(mol/L) |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由: _
【答案】(1)NO3- OH-(2)CO32-+2H+=CO2↑+H2O
(3)
阴离子 | 浓度c/(mol/L) |
CO32- | 0.125 |
SiO32- | 0.2 |
(4)存在,由电荷守恒可知K+最小浓度为1.15 molL-1
【解析】
试题分析:由题意知溶液为澄清溶液,因此溶液中含有的离子必须能大量共存.由实验Ⅰ可知,该溶液中一定含有CO32-,实验Ⅰ中生成气体的离子方程式为CO32-+2H+=CO2↑+H2O,其浓度为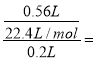 =0.125mol/L,则一定没有Ag+、Mg2+、Ba2+;由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,SiO32-的浓度为
=0.125mol/L,则一定没有Ag+、Mg2+、Ba2+;由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,SiO32-的浓度为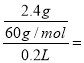 =0.2mol/L.由实验Ⅲ可知溶液中不含SO42-,根据电荷守恒2c(CO32-)+2c(SiO32-)+c(Cl-)=2×0.125mol/L+2×0.2mol/L+0.5 mol/L =1.15mol/L,因此溶液中一定含有K+,且其浓度至少为1.15mol/L,不能确定NO3-、OH-是否存在。
=0.2mol/L.由实验Ⅲ可知溶液中不含SO42-,根据电荷守恒2c(CO32-)+2c(SiO32-)+c(Cl-)=2×0.125mol/L+2×0.2mol/L+0.5 mol/L =1.15mol/L,因此溶液中一定含有K+,且其浓度至少为1.15mol/L,不能确定NO3-、OH-是否存在。

 科学实验活动册系列答案
科学实验活动册系列答案