题目内容
氮化铅 (AlN)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应: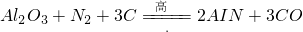 合成.下列叙述正确的是
合成.下列叙述正确的是
- A.上述反应中,N2是还原剂,Al2O3是氧化剂
- B.上述反应中,每生成lmol AlN需转移3mol电子
- C.AlN中氮元素的化合价为-3
- D.AlN的摩尔质量为41g
BC
分析:反应中N元素化合价降低,C元素化合价升高,N2是氧化剂,C时还原剂,根据元素化合价的变化判断得失电子的数目.
解答:A.N2是氧化剂,Al2O3既不是氧化剂也不是还原剂,故A错误;
B.反应中N元素化合价由0价降低到-3价,每生成lmol AlN需转移3mol电子,故B正确;
C.AlN中Al元素化合价为+3价,N元素化合价为-3价,故C正确;
D.AlN的摩尔质量为41g/mol,故D错误.
故选BC.
点评:本题考查氧化还原反应,侧重于元素化合价的判断,注意物质的性质与化合价变化的关系,题目难度不大.
分析:反应中N元素化合价降低,C元素化合价升高,N2是氧化剂,C时还原剂,根据元素化合价的变化判断得失电子的数目.
解答:A.N2是氧化剂,Al2O3既不是氧化剂也不是还原剂,故A错误;
B.反应中N元素化合价由0价降低到-3价,每生成lmol AlN需转移3mol电子,故B正确;
C.AlN中Al元素化合价为+3价,N元素化合价为-3价,故C正确;
D.AlN的摩尔质量为41g/mol,故D错误.
故选BC.
点评:本题考查氧化还原反应,侧重于元素化合价的判断,注意物质的性质与化合价变化的关系,题目难度不大.

练习册系列答案
相关题目
[化学-化学与技术]硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填标号);
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3 和SO2,该反应的化学方程式为______.
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是______.
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
仅用下表提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的是
| 选项 | 实验目的 | 仪器 |
| A | 除去氢氧化铝胶体中的泥沙 | 漏斗(带滤纸)、烧杯、玻璃棒 |
| B | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
| C | 用0.1000mol?L-1的盐酸测定未 知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
| D | 用MnO2和浓盐酸制取干燥、纯 净的Cl2 | 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 |
- A.A
- B.B
- C.C
- D.D
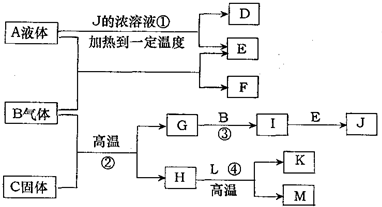 A-M有如图转化关系.已知D、L是相对分子质量相等的两种气体,且含有同一种元素,D是石油化工的重要基础原料,也是一种植物生长调节剂;A、E都是无色溶液,B是无色气体单质,反应②、③、④都是工业生产中的重要反应,H与J反应生成的溶液遇苯酚显紫色.(有些反应条件已省略)
A-M有如图转化关系.已知D、L是相对分子质量相等的两种气体,且含有同一种元素,D是石油化工的重要基础原料,也是一种植物生长调节剂;A、E都是无色溶液,B是无色气体单质,反应②、③、④都是工业生产中的重要反应,H与J反应生成的溶液遇苯酚显紫色.(有些反应条件已省略)