题目内容
下列实验的叙述,不正确的是( )
分析:A、根据不溶于稀盐酸的白色沉淀可以是硫酸钡也可以是氯化银;
B、根据试纸变蓝,说明溶液呈酸性,而醋酸钠是强碱盐;
C、根据碘不溶于水,易溶于CCl4,可用萃取来分离;
D、根据滴定管的O刻度在最上面;
B、根据试纸变蓝,说明溶液呈酸性,而醋酸钠是强碱盐;
C、根据碘不溶于水,易溶于CCl4,可用萃取来分离;
D、根据滴定管的O刻度在最上面;
解答:解:A、因白色沉淀生成可以是硫酸钡也可以是氯化银,故A错误;
B、因试纸变蓝,说明溶液呈酸性,而醋酸钠是强碱盐,根据盐类水解知识可知:醋酸是弱酸,故B正确;
C、因碘不溶于水,易溶于CCl4,可用萃取来分离,故C正确;
D、滴定管的O刻度在最上面,最大刻度在最下面,所以仰视读数,将导致读数偏大,故D正确;
故选:A.
B、因试纸变蓝,说明溶液呈酸性,而醋酸钠是强碱盐,根据盐类水解知识可知:醋酸是弱酸,故B正确;
C、因碘不溶于水,易溶于CCl4,可用萃取来分离,故C正确;
D、滴定管的O刻度在最上面,最大刻度在最下面,所以仰视读数,将导致读数偏大,故D正确;
故选:A.
点评:根据实验现象推出物质的性质,再根据物质的性质来解决问题,培养了学生分析问题的能力.

练习册系列答案
相关题目
t℃时,在两个相同的密闭刚性容器(等容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g) 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
数据分析发现:达到平衡时,化学状态Ⅰ和化学状态Ⅱ完全相同。下列叙述不正确的是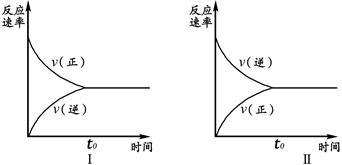
| A.若实验ⅠSO2的起始浓度为1mol/L,则实验ⅠO2的起始浓度为0.5mol/L;实验ⅡSO3的起始浓度为1mol/L. |
| B.若实验ⅠSO2的转化率为a%,则实验ⅡSO3 的转化率为1-a%。 |
| C.若起始浓度C(SO2) m mol/L,C(O2)=" n" mol/L,C(SO3)=" p" mol/L,在相同条件下进行实验,要求达到平衡时的状态与实验Ⅰ、Ⅱ完全相同,则m、n、p必须满足的条件是m/n="2" 和 m+p=1。 |
| D.维持实验Ⅰ的起始浓度和实验温度不变,改密闭刚性容器为密闭可变体积容器(等压容器)进行实验,达到化学平衡时:SO2的转化率与实验Ⅰ中SO2的转化率相比要小,但正反应速率与实验Ⅱ相比要大。 |
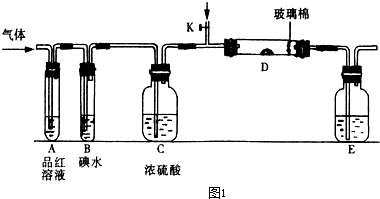

 入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的
入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若装置D中装的 是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。 酸 C.硝酸钾溶
酸 C.硝酸钾溶 液 D.硫化钠溶液
液 D.硫化钠溶液 l2与含X的溶液反应的离子方程式 。
l2与含X的溶液反应的离子方程式 。

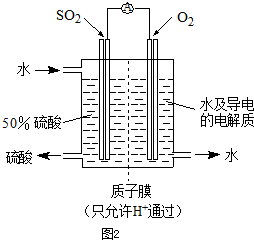
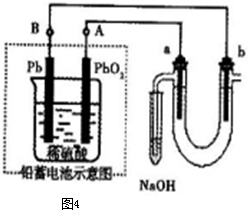
 ,a为正扳,d为阳极
,a为正扳,d为阳极 2、NH3、Cl2,、HCl、NO2等
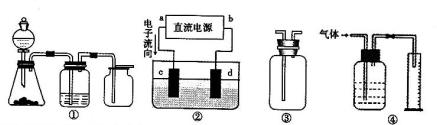
2、NH3、Cl2,、HCl、NO2等 .装置④能用于测量气体体积
.装置④能用于测量气体体积



