��Ŀ����
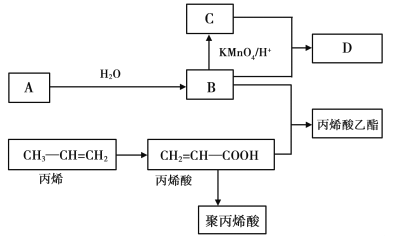
����Ŀ��ij��ѧ�����ö������棨CeO2����̫���������½�H2O��CO2ת���H2��CO����������£�
mCeO2![]() ��m��x��CeO2xCe+xO2
��m��x��CeO2xCe+xO2
��m��x��CeO2xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
����˵������ȷ���ǣ� ��

A���ù�����CeO2û������
B���ù���ʵ����̫������ѧ�ܵ�ת��
C��ͼ����H1=��H2+��H3
D����CO��O2���ɵļ���ȼ�ϵ�صĸ�����ӦʽΪCO+4OH����2e��=CO32��+2H2O
���𰸡�C
��������
���������A��������ɷ�Ӧ����ʽд���ܷ�Ӧ��H2O+CO2��H2+CO+O2����Ӧ��CeO2û�����ģ�
B���ù�������̫���������½�H2O��CO2ת��ΪH2��CO��
C�����ݸ�˹���ɼ�ͼ��ת����ϵ���з�����
D��ԭ����и���ʧȥ���ӷ���������Ӧ��
�⣺A��ͨ��̫����ʵ���ܷ�ӦH2O+CO2��H2+CO+O2��֪��CeO2û�����ģ�CeO2Ϊ��������A��ȷ��
B���ù�������̫���������½�H2O��CO2ת��ΪH2��CO������̫����ת��ɻ�ѧ�ܣ���B��ȷ��
C����ͼ��ת����ϵ���ݸ�˹���ɿ�֪������H1Ϊ��ֵ����H2+��H3Ϊ��ֵ������H1=��H2+��H3����C����
D��CO�ڸ���ʧ��������CO2���ڼ�������������OH������CO32�����ʸ�����ӦʽΪ��CO+4OH����2e��=CO32��+2H2O����D��ȷ��
��ѡC��