题目内容
X、Y、Z、W四种短周期元素在周期表中相对位置如表所示,Y、Z质子数之和为21,下列说法中不正确的是( )
| X | Y | ||
| Z | W |
| A.X、Y、Z、W均为非金属元素 |
| B.X、Y、W的氢化物中,Y的氢化物沸点最高 |
| C.Z的阳离子与Y的阴离子电子层结构相同 |
| D.W元素的简单离子半径大于Z元素的简单离子半径 |
因短周期中的位置为二、三周期,设Y的质子数为x,则X的质子数为x-2,W的质子数为x+8,Z的质子数为x+5,根据Y、Z质子数之和为21,
则x+(x+5)=21,解得x=8,即X为碳元素,Y为氧元素;Z为铝元素,W为硫元素;
A、碳、氧、硫属于非金属元素,而铝属于金属元素,故A不正确;
B、甲烷、水、硫化氢的晶体类型都属于分子晶体,但水中都存在氢键,熔沸点大于硫化氢,甲烷的相对分子之间最小,则沸点最小,即氢键的作用力更大,所以水的熔沸点最高,故B正确;
C、铝离子的电子数为13-3=10,氧离子的电子数为8+2=10,则离子电子层结构相同,故C正确;
D、硫离子有三个电子层,而铝离子有两个电子层,即硫离子的半径大于铝离子的半径,故D正确;
故选A.
则x+(x+5)=21,解得x=8,即X为碳元素,Y为氧元素;Z为铝元素,W为硫元素;
A、碳、氧、硫属于非金属元素,而铝属于金属元素,故A不正确;
B、甲烷、水、硫化氢的晶体类型都属于分子晶体,但水中都存在氢键,熔沸点大于硫化氢,甲烷的相对分子之间最小,则沸点最小,即氢键的作用力更大,所以水的熔沸点最高,故B正确;
C、铝离子的电子数为13-3=10,氧离子的电子数为8+2=10,则离子电子层结构相同,故C正确;
D、硫离子有三个电子层,而铝离子有两个电子层,即硫离子的半径大于铝离子的半径,故D正确;
故选A.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是( )
| X | Y |
| Z | W |
| A、W的原子序数可能是Y的原子序数的2倍 |
| B、Z元素的原子半径可能比Y元素的小 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、若Z的最高正价为+m,则X的最高正价也一定为+m |
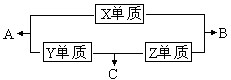 X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
 有X、Y、Z、W四种短周期元素的位置关系如图所示,已知W为该族中半径最小的元素,Z为该周期中原子半径最小的元素.
有X、Y、Z、W四种短周期元素的位置关系如图所示,已知W为该族中半径最小的元素,Z为该周期中原子半径最小的元素.
