题目内容
常温下,一种烷烃A和一种单烯烃B组成混合气体.A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多.
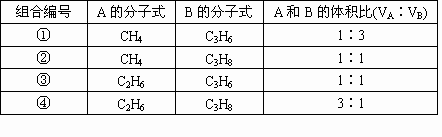
(1)将1L该混合气体充分燃烧,在同温、同压下得到2.5L CO2气体.试推断原混合气体中A和B所有可能的组合及其体积比,并将讨论结果填入下表.

(2)120℃时取1L该混合气体与9L O2混合,充分燃烧,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定A和B的分子式.
解析:
|
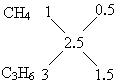
解析: (1)设混合气体的平均分子式为CxHy 根据1mol CxHy~x mol CO2 ∴x=2.5 故混合烃的平均分子式为C2.5Hy. 依据题中已知条件的限制,混合气体只能由碳原子数小于2.5的烷烃——CH4和C2H6及碳原子数大于2.5的烯烃——C3H6和C4H8组成.它们能形成4种组合方式.然后根据每一种组合中烷烃和烯烃的碳原子数及平均分子式中的碳原子数用十字交叉法确定A和B的体积比. 以第①组为例: 同理,可求出其他各组中A和B的体积比
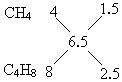
(2)CxHy+(x+ 1 1 10×6.25% y=6.5 即:混合物中氢原子的平均组成为6.5. 根据平均值的规律,混合物中烃分子所含氢原子必一个大于6.5,一个小于6.5,因此,可能的组合只有②和④. 若是②组,由十字交叉法可求VA∶VB:
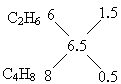
若是④组,由十字交叉法可求VA∶VB:
所以,可确定A、B的分子式为C2H6和C4H8. 答案:略. 解题技巧: 这道题的解题过程运用了平均值的方法和十字交叉法.先根据已知条件确定混合烃的平均分子式,然后用平均值法确定混合烃的组合,最后再用十字交叉法求两种烃的体积比(物质的量比).这种方法在混合烃的计算中是常用的.此外,已知混合烃的平均摩尔质量,也可利用平均值法和十字交叉法确定混合烃的组成. |

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A、CH4、C3H6 | B、C2H6、C3H6 | C、CH4、C4H8 | D、C2H6、C4H8 |
常温下,一种烷烃A和一种烯烃B组成混合气体,A、B分子最多只含4个碳原子,且B分子的碳原子数比A分子的多。将1L该混合气体充分燃烧,在同温同压下得到2.5LCO2气体,试推断混合气体中A和B所有可能的组合及其体积比,并将结果填如下表:
| 组合编号 | A的分子式 | B的分子式 | A和B是体积比 (VA:VB) |
| ① | |||
| ② | |||
| ③ | |||
| ④ |
常温下,一种烷烃A和一种烯烃B组成的混合气体。A和B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1)将1 L该混合气体充分燃烧,在同温、同压下得到2.5 L CO2气体。试推断原混合气体中A和B所有可能的组合及其体积比,并将结论填入下表。
| 组合编号 | A的分子式 | B的分子式 | A和B的体积比V(A)∶V(B) |
(2)120 ℃时取1 L该混合气体与9 L O2混合,充分燃烧,当恢复到120 ℃和燃烧前的压强时,体积增大6.25%。试通过计算确定A和B的分子式。
常温下,一种烷烃A和一种单烯烃B组成混合气体,A或B分子中最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
⑴将1L该混合气体充分燃烧,在同温同压下得到2.5LCO2气体。试推断原混合气体中A和B所有可能的组合及其体积比,并将结果填入下表:
| 组合编号 | A的分子式 | B的分子式 | A、B的体积比 |
| ① | |||
| ② | |||
| ③ | |||
| ④ |
⑵120℃时取1L该混合气体与9LO2混合,充分燃烧,当恢复到120℃和原压强时,体积增大6.25%,试通过计算确定A、B的分子式。