题目内容
现有浓度均为0.1mol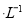 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(l)①、②、③、④四种溶液中由水电离出的浓度由大到小的顺序是___________________
_____________________________________(填序号)。
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是_________________(填序号)。
(3)将③和④按体积比l:2混合后,溶液的pH>7,则混合液中各离子浓度由大到小的顺序是________________________________________。
(4)已知t℃时,Kw=1×10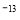 ,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
(1)④②③①(2分)
(2)⑥④⑤⑦(2分)
(3)c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)(2分)
(4)>;(2分) 9:2(2分)
【解析】
试题分析:(1)④的溶液中盐的水解对水的电离起促进作用,最大;酸碱溶液中对水的电离起抑制作用,但②的H+浓度最小,抑制作用小,①的H+浓度最大,抑制作用最大,所以四种溶液中由水电离出的浓度由大到小的顺序是④②③①;
(2)④中NH4+水解,Cl-不水解,⑤醋酸根离子对NH4+水解起促进作用,⑥硫酸氢铵电离产生的H+对NH4+水解起抑制作用,⑦只是一水合氨的电离产生NH4+,综上所述NH4+浓度由大到小的顺序是⑥④⑤⑦;
(3)将③和④按体积比l:2混合后,所得溶液为同浓度的氯化钠、氯化铵、一水合氨的混合液,溶液呈碱性,说明一水合氨的电离大于氯化铵的水解程度,所以混合液中各离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)Kw是温度常数随温度升高而增大,1×10-13>1×10-14所以t℃>25℃;混合溶液的pH=2说明c(H+)=0.01mol/L,所以c(H+)×b- c(OH-)×a=0.01×(a+b),解得a:b=9:2
考点:考查不同溶液中同一离子浓度大小的比较、混合液中不同离子浓度大小的判断、混合液的有关计算

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案